20 Feu

Dans le charbon et les pétards, une réaction chimique se produit dans laquelle le carbone est oxydé en CO2. Le charbon réagit avec l'oxygène de l'air, tandis que les pétards contiennent des substances riches en oxygène comme le nitrate de potassium (KNO3) pour assurer une réaction rapide. Une réaction de combustion est une réaction d'oxydoréduction entre un combustible et un oxydant, généralement de l'oxygène.
Notre soleil est constitué de 73,5 % d'hydrogène. Cet hydrogène ne brûle pas dans une réaction chimique, mais il est transformé en hélium lors de la fusion nucléaire.
Dans le charbon et les pétards, une réaction chimique se produit dans laquelle le carbone est oxydé en CO2. Le charbon réagit avec l'oxygène de l'air, tandis que les pétards contiennent des substances riches en oxygène comme le nitrate de potassium (KNO3) pour assurer une réaction rapide. Une réaction de combustion est une réaction d'oxydoréduction entre un combustible et un oxydant, généralement de l'oxygène.
Notre soleil est constitué de 73,5 % d'hydrogène. Cet hydrogène ne brûle pas dans une réaction chimique, mais il est transformé en hélium lors de la fusion nucléaire.

Un feu est éteint en enlevant soit l'oxygène, soit la chaleur, soit le combustible.
L'extincteur étouffe le feu en chassant l'oxygène avec du dioxyde de carbone (CO2). Il peut cependant se rallumer dès que l'oxygène entre à nouveau en contact avec l'huile chaude.
L'eau et l'huile ne se mélangent pas, et comme l'eau est plus dense que l'huile, elle se dépose sous l'huile. La température élevée porte l'eau à ébullition et la vapeur en expansion pulvérise l'huile brûlante, provoquant une flamme violente.
Le fait de couvrir le feu sépare le feu de l'oxygène, ce qui l'étouffe. De plus, cela permet à l'huile de se refroidir suffisamment.
Un feu est éteint en enlevant soit l'oxygène, soit la chaleur, soit le combustible.
L'extincteur étouffe le feu en chassant l'oxygène avec du dioxyde de carbone (CO2). Il peut cependant se rallumer dès que l'oxygène entre à nouveau en contact avec l'huile chaude.
L'eau et l'huile ne se mélangent pas, et comme l'eau est plus dense que l'huile, elle se dépose sous l'huile. La température élevée porte l'eau à ébullition et la vapeur en expansion pulvérise l'huile brûlante, provoquant une flamme violente.
Le fait de couvrir le feu sépare le feu de l'oxygène, ce qui l'étouffe. De plus, cela permet à l'huile de se refroidir suffisamment.

Le diamètre d'une seule spore de lycopode séchée est d'environ 33 micromètres. Elles sont riches en huile et, en raison de leur petite taille, elles ont une grande surface lorsqu'elles sont pulvérisées dans l'air, ce qui les fait brûler très facilement. Ces spores étaient déjà utilisées comme effets pyrotechniques dans le moyen-âge et offrent une alternative moins dangereuse que les crachats de feu conventionnels utilisant des liquides inflammables.

Le diamètre d'une seule spore de lycopode séchée est d'environ 33 micromètres. Elles sont riches en huile et, en raison de leur petite taille, elles ont une grande surface lorsqu'elles sont pulvérisées dans l'air, ce qui les fait brûler très facilement. Ces spores étaient déjà utilisées comme effets pyrotechniques dans le moyen-âge et offrent une alternative moins dangereuse que les crachats de feu conventionnels utilisant des liquides inflammables.


Le fer de la laine qui brûle est oxydé par l'oxygène. L'oxyde de fer qui se forme est un solide contenant des atomes de fer et d'oxygène. Les atomes d'oxygène qui se lient au fer sont responsables de la masse supérieure de la laine brûlée.
Les substances organiques comme le bois ou la cire deviennent moins lourd en brûlant, car les produits, CO2 et H2O (vapeur), sont des gaz.
Le fer de la laine qui brûle est oxydé par l'oxygène. L'oxyde de fer qui se forme est un solide contenant des atomes de fer et d'oxygène. Les atomes d'oxygène qui se lient au fer sont responsables de la masse supérieure de la laine brûlée.
Les substances organiques comme le bois ou la cire deviennent moins lourd en brûlant, car les produits, CO2 et H2O (vapeur), sont des gaz.

Comment fait-on pour obtenir un feu d'artifice de couleur verte ?
Un feu d'artifice vert s'obtient en ajoutant du sel blanc. Il ne s'agit pas de sel ordinaire, NaCl, mais de sel de baryum ou de cuivre. Lorsque les feux d'artifice explosent, les électrons des atomes de baryum et de cuivre sont excités. Cela signifie que les électrons sautent à un niveau d'énergie plus élevé. De là, ils retombent à leur niveau d'origine, libérant de la lumière. Dans le cas du baryum et du cuivre, cette lumière émise est verte.

Un feu d'artifice vert s'obtient en ajoutant du sel blanc. Il ne s'agit pas de sel ordinaire, NaCl, mais de sel de baryum ou de cuivre. Lorsque les feux d'artifice explosent, les électrons des atomes de baryum et de cuivre sont excités. Cela signifie que les électrons sautent à un niveau d'énergie plus élevé. De là, ils retombent à leur niveau d'origine, libérant de la lumière. Dans le cas du baryum et du cuivre, cette lumière émise est verte.

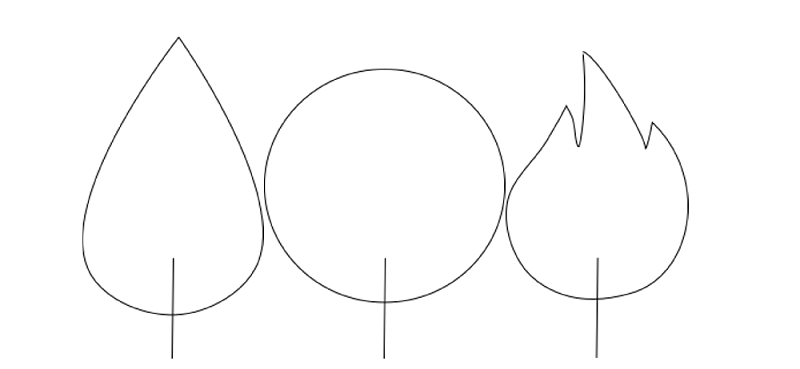
Sur terre, une flamme a la forme d'une larme. En revanche, une flamme dans la station spatiale internationale (ISS) a une forme ronde et sphérique. Sur Terre, l'air chaud monte parce qu'il a une densité plus faible que l'air froid. Pendant ce temps, l'air froid et riche en oxygène est aspiré dans la flamme par le bas. C'est ce qui donne à la flamme sa forme de goutte. Il n'y a pas de gravité dans l'ISS, et donc pas de direction dans laquelle les gaz légers montent. Cela permet aux gaz brûlants de se répandre uniformément autour de la mèche, la flamme est sphérique.

Sur terre, une flamme a la forme d'une larme. En revanche, une flamme dans la station spatiale internationale (ISS) a une forme ronde et sphérique. Sur Terre, l'air chaud monte parce qu'il a une densité plus faible que l'air froid. Pendant ce temps, l'air froid et riche en oxygène est aspiré dans la flamme par le bas. C'est ce qui donne à la flamme sa forme de goutte. Il n'y a pas de gravité dans l'ISS, et donc pas de direction dans laquelle les gaz légers montent. Cela permet aux gaz brûlants de se répandre uniformément autour de la mèche, la flamme est sphérique.


Le mot phlogistique vient du grec et signifie "brûlé". C'est une substance hypothétique qui a été introduite au XVIIe siècle par Georg Ernst Stahl pour expliquer les combustions. À l'époque, on pensait que le phlogistique se trouvait dans tous les matériaux combustibles et qu'il s'échappait en cas de combustion. Ce n'est qu'après presque un siècle, que le chimiste Antoine de Lavoisier a démenti cette théorie et prouvé que l'oxygène joue un rôle décisif dans la combustion.
Le mot phlogistique vient du grec et signifie "brûlé". C'est une substance hypothétique qui a été introduite au XVIIe siècle par Georg Ernst Stahl pour expliquer les combustions. À l'époque, on pensait que le phlogistique se trouvait dans tous les matériaux combustibles et qu'il s'échappait en cas de combustion. Ce n'est qu'après presque un siècle, que le chimiste Antoine de Lavoisier a démenti cette théorie et prouvé que l'oxygène joue un rôle décisif dans la combustion.

Notre corps possède ce qu'on appelle des récepteurs de chaleur qui signalent la chaleur au cerveau à partir d'une température de 42 °C. Si nous buvons de l'alcool, qui est de l'éthanol, il interagit avec ces récepteurs de chaleur. Cela permet d'abaisser la température d'activation de ces récepteurs à environ 34 °C. Mais comme la température corporelle d'un être humain est d'environ 37 °C, la température du corps est suffisante pour déclencher une sensation de chaleur.
Notre corps possède ce qu'on appelle des récepteurs de chaleur qui signalent la chaleur au cerveau à partir d'une température de 42 °C. Si nous buvons de l'alcool, qui est de l'éthanol, il interagit avec ces récepteurs de chaleur. Cela permet d'abaisser la température d'activation de ces récepteurs à environ 34 °C. Mais comme la température corporelle d'un être humain est d'environ 37 °C, la température du corps est suffisante pour déclencher une sensation de chaleur.

Ce quiz a été élaboré par le Luxembourg Science Center à Differdange. Visitez le centre pour en savoir plus sur le feu et bien d'autres thèmes scientifiques !
Ce quiz a été élaboré par le Luxembourg Science Center à Differdange. Visitez le centre pour en savoir plus sur le feu et bien d'autres thèmes scientifiques !
Avant de découvrir votre résultat, laissez-nous un email de contact si vous souhaitez participer au tirage au sort des meilleurs scores et gagner des entrées gratuites au Luxembourg Science Center !