(1): Βιοενεργητική, Θερμοδυναμική και Οξειδοαναγωγικές Αντιδράσεις - ΝΠρ
Εάν η ΔG'° της αντίδρασης Α → Β είναι −40kJ/mol, υπό κανονικές συνθήκες η αντίδραση:
Βρίσκεται σε ισορροπία
Δεν θα φτάσει ποτέ την ισορροπία
Δεν θα πραγματοποιηθεί αυθόρμητα
Θα προχωρήσει με ταχύ ρυθμό
Θα προχωρήσει αυθόρμητα προς τα δεξιά
Για την αντίδραση Α → Β, η ΔG'° είναι −60kJ/mol. Η αντίδραση ξεκίνησε με 10mmol A και αρχικά δεν υπήρχε καθόλου Β. Μετά από 24 ώρες, εξακριβώθηκε η παρουσία 2mmol B και 8mmol A. Ποια είναι η πιθανότερη εξήγηση;
Οι Α και Β έχουν φτάσει σε συγκεντρώσεις ισορροπίας
Ένα ένζυμο έχει μετατοπίσει την ισορροπία προς το μέρος της Α
Ο σχηματισμός της Β είναι κινητικά αργός, και η ισορροπία δεν έχει επιτευχθεί εντός 24 ωρών
Ο σχηματισμός της Β δεν είναι θερμοδυναμικά ευνοϊκός
Το αποτέλεσμα που περιγράφεται είναι αδύνατο, δεδομένου ότι η ΔG'° είναι −60kJ/mol
Όταν ένα μείγμα 3-φωσφογλυκερινικού και 2-φωσφογλυκερινικού επωάζεται στους 25°C με φωσφογλυκερινική μουτάση μέχρι να επιτευχθεί ισορροπία, το τελικό μείγμα περιέχει έξι φορές περισσότερο 2-φωσφογλυκερινικό από ό,τι 3-φωσφογλυκερινικό. Ποια από τις ακόλουθες δηλώσεις είναι ορθή, όσον αφορά στην αντίδραση που αναφέρεται; (R = 8,315 J/mol•K, T = 298K)
ΔG'° = −4,44 kJ/mol
Η ΔG'° είναι μηδέν
ΔG'° = +12,7 kJ/mol
Η ΔG'° είναι ανυπολόγιστα μεγάλη και θετική
Η ΔG'° δεν μπορεί να υπολογιστεί από τα δεδομένα
Όταν ένα μείγμα 6-φωσφορικής γλυκόζης και 6-φωσφορικής φρουκτόζης επωάζεται με το ένζυμο ισομεράση των φωσφορικών εξοζών (το οποίο καταλύει την αλληλομετατροπή των δύο αυτών ουσιών) μέχρι να επιτευχθεί ισορροπία, το τελικό μείγμα περιέχει διπλάσια ποσότητα 6-φωσφορικής γλυκόζης από ό,τι 6-φωσφορική φρουκτόζη. Ποια από τις ακόλουθες δηλώσεις ισχύει για την αντίδραση που αναφέρεται; (R = 8,315 J/mol•K, T = 298K)
Η ΔG'° είναι ανυπολόγιστα μεγάλη και αρνητική
ΔG'° = −1,72 kJ/mol
Η ΔG'° είναι μηδέν
ΔG'° = +1,72 kJ/mol
Η ΔG'° είναι ανυπολόγιστα μεγάλη και θετική
Η υδρόλυση 1Μ 6-φωσφορικής γλυκόζης που καταλύεται από τη φωσφατάση της 6-φωσφορικής γλυκόζης είναι πλήρης κατά 99% στην ισορροπία (δηλαδή παραμένει μόνο το 1% του υποστρώματος). Ποια από τις ακόλουθες δηλώσεις είναι σωστή; (R = 8,315 J/mol•K, T = 298K)
ΔG'° = −11 kJ/mol
ΔG'° = −5 kJ/mol
Η ΔG'° είναι μηδέν
ΔG'° = +11 kJ/mol
Η ΔG'° δεν μπορεί να υπολογιστεί από τα δεδομένα
Η αντίδραση Α + Β → Γ έχει ΔG'° = −20 kJ/mol. Αρχίζοντας υπό κανονικές συνθήκες, μπορούμε να υποθέσουμε ότι:
Στην ισορροπία, η συγκέντρωση της Β θα είναι μεγαλύτερη από τη συγκέντρωση της Α
Στην ισορροπία, η συγκέντρωση της Γ θα είναι μικρότερη από τη συγκέντρωση της Α
Στην ισορροπία, η συγκέντρωση της Γ θα είναι πολύ μεγαλύτερη από τη συγκέντρωση της Α ή της Β
Η Γ θα αποδομηθεί ταχέως σε Α + Β
Όταν οι Α και Β αναμειχθούν, η αντίδραση θα προχωρήσει ταχύτητα προς σχηματισμό της Γ
Ποια από τις ακόλουθες ενώσεις έχει τη μεγαλύτερη αρνητική τιμή μεταβολής της πρότυπης ελεύθερης ενέργειας (ΔG'°) κατά την υδρόλυσή της;
(CH₃COO)₂O (οξικός ανυδρίτης)
6-φωσφορική γλυκόζη
Γλουταμίνη
3-φωσφορική γλυκερόλη
Λακτόζη
Για την αντίδραση L-μηλικό + NAD⁺ → οξαλοξικό + NADH + H⁺ , η ΔG'° = +29,7 kJ/mol. Η δεδομένη αντίδραση:
Δεν μπορεί ποτέ να πραγματοποιηθεί στο κύτταρο
Μπορεί να πραγματοποιηθεί στο κύτταρο μόνο εάν συζευχθεί με μια άλλη αντίδραση της οποίας η ΔG'° είναι θετική
Μπορεί να πραγματοποιηθεί μόνο σε ένα κύτταρο στο οποίο το NADH μετατρέπεται σε NAD⁺ με μεταφορά ηλεκτρονίων
Δεν μπορεί να πραγματοποιηθεί εξαιτίας της υψηλής ενέργειας ενεργοποίησής της
Μπορεί να συμβεί στα κύτταρα σε ορισμένες συγκεντρώσεις υποστρωμάτων και προϊόντων
Για την αντίδραση Α → Β, η Keq' = 10⁴. Εάν ένα μείγμα αρχικά περιέχει 1mmol A και καθόλου Β, ποιο από τα ακόλουθα είναι αληθές;
Στην ισορροπία, θα υπάρχει πολύ περισσότερη Β από ό,τι Α
Η ταχύτητα της αντίδρασης είναι πολύ μικρή
Η αντίδραση χρειάζεται σύζευξη με μια εξεργονική αντίδραση ώστε να προχωρήσει
Η αντίδραση θα προχωρήσει προς το μέρος της Β με πολύ μεγάλη ταχύτητα
Η ΔG'° για την αντίδραση θα είναι μεγάλη και θετική
Στη γλυκόλυση, η 1,6-διφωσφορική φρουκτόζη μετατρέπεται σε δύο προϊόντα με μεταβολή της πρότυπης ελεύθερης ενέργειας (ΔG'°) ίση με 23,8 kJ/mol. Υπό ποιες συνθήκες, οι οποίες απαντώνται σε ένα φυσιολογικό κύτταρο, η μεταβολή της ελεύθερης ενέργειας (ΔG) θα είναι αρνητική, επιτρέποντας στην αντίδραση να προχωρήσει αυθόρμητα προς τα δεξιά;
Υπό κανονικές συνθήκες, ελευθερώνεται αρκετή ενέργεια ώστε η αντίδραση να οδηγηθεί προς τα δεξιά
Η αντίδραση δεν θα προχωρήσει προς τα δεξιά αυθόρμητα υπό καμία συνθήκη διότι η ΔG'° είναι θετική
Η αντίδραση θα προχωρήσει αυθόρμητα προς τα δεξιά εάν υπάρχει υψηλή συγκέντρωση προϊόντων σε σχέση με τη συγκέντρωση της 1,6-διφωσφορικής φρουκτόζης
Η αντίδραση θα προχωρήσει αυθόρμητα προς τα δεξιά εάν υπάρχει υψηλή συγκέντρωση 1,6-διφωσφορικής φρουκτόζης σε σχέση με τη συγκέντρωση των προϊόντων
Καμία από τις παραπάνω συνθήκες δεν είναι επαρκής
Κατά τη γλυκόλυση, η 1-φωσφορική γλυκόζη μετατρέπεται σε 6-φωσφορική φρουκτόζη σε δύο διαδοχικές αντιδράσεις: ① 1-φωσφορική γλυκόζη → 6-φωσφορική γλυκόζη (με ΔG'° = −7,1 kJ/mol) και ② 6-φωσφορική γλυκόζη → 6-φωσφορική φρουκτόζη (με ΔG'° = +1,7 kJ/mol). Η ΔG'° για τη συνολική αντίδραση είναι:
�8,8 kJ/mol
�7,1 kJ/mol
�5,4 kJ/mol
+5,4 kJ/mol
+8,8 kJ/mol
Δίνονται οι μεταβολές της πρότυπης ελεύθερης ενέργειας για τις παρακάτω αντιδράσεις: ① Φωσφοκρεατίνη → κρεατίνη + Pᵢ (ΔG'° = −43,0 kJ/mol) και ② ATP → ADP + Pᵢ (ΔG'° = −30,5 kJ/mol). Ποια είναι η ολική ΔG'° για την αντίδραση: Φωσφοκρεατίνη + ADP → κρεατίνη + ATP;
�73,5 kJ/mol
�12,5 kJ/mol
+12,5 kJ/mol
+73,5 kJ/mol
Η ΔG'° δεν μπορεί να υπολογιστεί χωρίς την Keq'
Δίνονται οι ΔG'° για τις παρακάτω αντιδράσεις: ① Οξαλοξικό + ακετυλο-CoA + H₂O → κιτρικό + CoA-SH (ΔG'° = −32,2 kJ/mol) και ② Οξαλοξικό + οξικό → κιτρικό (ΔG'° = −1,9 kJ/mol). Ποια είναι η ολική ΔG'° για την υδρόλυση του ακετυλο-CoA: Ακετυλο-CoA + H₂O → οξικό + CoA-SH + H⁺;
�34,1 kJ/mol
�32,2 kJ/mol
�30,3 kJ/mol
+61,9 kJ/mol
+34,1 kJ/mol
Όλα τα ακόλουθα συνεισφέρουν στη μεγάλη, αρνητική, μεταβολή της ελεύθερης ενέργειας κατά την υδρόλυση ενώσεων υψηλής ενέργειας, εκτός από:
Ηλεκτροστατική άπωση στο αντιδρών
Χαμηλή ενέργεια ενεργοποίησης
Σταθεροποίηση των προϊόντων από επιπλέον μορφές συντονισμού
Σταθεροποίηση των προϊόντων με ιονισμό
Σταθεροποίηση των προϊόντων με διαλυτοποίηση
Η υδρόλυση του ATP έχει μεγάλη, αρνητική ΔG'°. Παρόλα αυτά, το ATP είναι σταθερό σε διάλυμα λόγω:
Σταθεροποίησης της εντροπίας
Ιονισμό των φωσφορικών
Σταθεροποίηση με συντονισμό
Της ενδεργονικής φύσης της αντίδρασης υδρόλυσης
Της υψηλής ενέργειας ενεργοποίησης της αντίδρασης υδρόλυσης
Η υδρόλυση του φωσφοενολοπυροσταφυλικού προχωρά με ΔG'° περίπου ίση με −62 kJ/mol. Οι σημαντικότεροι παράγοντες που συνεισφέρουν σε αυτήν την αντίδραση είναι η αποσταθεροποίηση των αντιδρώντων με ηλεκτροστατική άπωση και η σταθεροποίηση του προϊόντος (πυροσταφυλικό) με:
Ηλεκτροστατική έλξη
Ιονισμό
Πόλωση
Συντονισμό
Ταυτομέρεια
Ποια από τις ακόλουθες ενώσεις δεν έχει μεγάλη, αρνητική ελεύθερη ενέργεια υδρόλυσης;
1,3-διφωσφογλυκερινικό
3-φωσφογλυκερινικό
ADP
Φωσφοενολοπυροσταφυλικό
Θειοεστέρες (π.χ. ακετυλο-CoA)
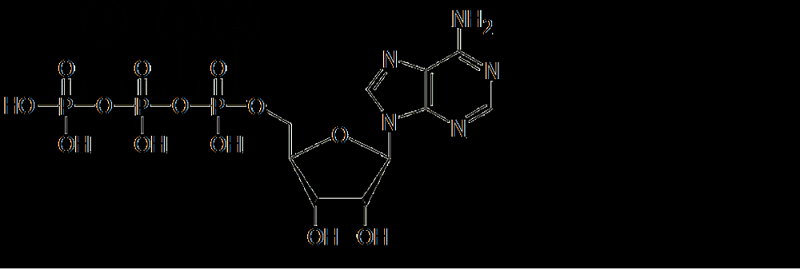
Οι αμέσως πρόδρομες ουσίες του DNA και του RNA στη σύνθεσή τους στο κύτταρο περιέχουν:
3' τριφωσφορικά
5' τριφωσφορικά
Αδενίνη
Δεοξυριβόζη
Ριβόζη
Η μυϊκή συστολή περιλαμβάνει τη μετατροπή:
Χημικής ενέργειας σε κινητική
Χημικής ενέργειας σε δυναμική
Κινητικής ενέργειας σε χημική
Δυναμικής ενέργειας σε χημική
Δυναμικής ενέργειας σε κινητική
Οι βιολογικές οξειδοαναγωγικές αντιδράσεις περιλαμβάνουν πάντοτε:
Άμεση συμμετοχή οξυγόνου
Σχηματισμό νερού
Μιτοχόνδρια
Μεταφορά ηλεκτρονίων
Μεταφορά υδρογόνων
Δίνονται τα πρότυπα δυναμικά αναγωγής (E'°) για τις ακόλουθες ημιαντιδράσεις: ① Φουμαρικό + 2H⁺ + 2e⁻ → ηλεκτρικό (E'° = +0,031V) και ② FAD + 2H⁺ + 2e⁻ → FADH₂ (E'° = −0,219V). Εάν αναμείξουμε φουμαρικό, FAD και FADH₂, όλα σε συγκέντρωση 1Μ, και παρουσία δεϋδρογονάσης του ηλεκτρικού, ποιο από τα ακόλουθα θα συμβεί αρχικά;
Το φουμαρικό και το ηλεκτρικό θα οξειδωθούν και το FAD και το FADH₂ θα αναχθούν
Το φουμαρικό θα αναχθεί και το FADH₂ θα οξειδωθεί
Δεν θα συμβεί οποιαδήποτε αντίδραση διότι όλα τα αντιδρώντα και προϊόντα είναι ήδη στις κανονικές τους συγκεντρώσεις
Το ηλεκτρικό θα οξειδωθεί και το FAD θα αναχθεί
Το ηλεκτρικό θα οξειδωθεί και το FADH₂ θα παραμείνει αμετάβλητο διότι είναι συμπαράγοντας
Η E'° της ημιαντίδρασης NAD⁺/NADH είναι −0,32V. Η E'° της ημιαντίδρασης οξαλοξικό/μηλικό είναι −0,175V. Όταν οι συγκεντρώσεις των NAD⁺, NADH, οξαλοξικό και μηλικό είναι όλες 10⁻⁵M, η αυθόρμητη αντίδραση είναι η:
Μηλικό + NAD⁺ → οξαλοξικό + NADH + H⁺
Μηλικό + NADH + H⁺ → οξαλοξικό + NAD⁺
NAD⁺ + NADH + H⁺ → μηλικό + οξαλοξικό
NAD⁺ + οξαλοξικό → NADH + H⁺ + μηλικό
Οξαλοξικό + NADH + H⁺ → μηλικό + NAD⁺
Η δομή του NAD⁺ δεν περιλαμβάνει:
Φλαβινονουκλεοτίδιο
Πυροφωσφορικό δεσμό
Αδενινονουκλεοτίδιο
Νικοτιναμίδιο
Δύο ριβοζικά κατάλοιπα
Εάν ένα διάλυμα 1-φωσφορικής γλυκόζης, συγκέντρωσης 0,1Μ, επωαστεί με καταλυτική ποσότητα φωσφογλυκομουτάσης, η 1-φωσφορική γλυκόζη μετατρέπεται σε 6-φωσφορική γλυκόζη μέχρι να επιτευχθεί ισορροπία. Στην ισορροπία, η συγκέντρωση της 1-φωσφορικής γλυκόζης είναι 4,5•10⁻³M και η συγκέντρωση της 6-φωσφορικής γλυκόζης είναι 8,6•10⁻²Μ. Εάν R = 8,315 J/mol•K και T = 298K, τότε:
ΔG'° = +7,3 kJ/mol
ΔG'° = −7,3 kJ/mol
Η ΔG'° είναι μηδέν
Η ΔG'° δεν μπορεί να υπολογιστεί από τα δεδομένα
ΔG'° = 19 kJ/mol
Ποια από τις ακόλουθες δηλώσεις αληθεύει;
Σε μια αντίδραση υπό κανονικές συνθήκες, μόνο τα αντιδρώντα είναι σε συγκέντρωση 1Μ
Όταν η ΔG'° είναι θετική, τότε η Keq' > 0
Οι συμβολισμοί ΔG Και ΔG'° είναι ταυτόσημοι
Όταν ΔG'° = 1,0 kJ/mol, τότε Keq' = 1
Καμία από τις πιο πάνω
Στη γλυκόλυση, το ένζυμο κινάση του πυροσταφυλικού καταλύει την αντίδραση: Φωσφοενολοπυροσταφυλικό + ADP → πυροσταφυλικό + ATP. Η αντίδραση αυτή πραγματοποιείται μέσω των αντιδράσεων: ① ATP → ADP + Pᵢ (ΔG'° = −30,5 kJ/mol) και ② Φωσφοενολοπυροσταφυλικό → πυροσταφυλικό + Pᵢ (ΔG'° = −61,9 kJ/mol). Εάν R = 8.315 J/mol·K και T = 298 K, τότε η σταθερά ισορροπίας της αρχικής αντίδρασης είναι:
Keq' = 0
Keq' = 12,672
Keq' = 3,19·10⁵
Keq' = 1
Keq' = 3,13·10⁻⁶
Κατά τη μεταφορά δύο ηλεκτρονίων μέσω της μιτοχονδριακής αναπνευστικής αλυσίδας, η ολική αντίδραση είναι: NADH + ½O₂ + H⁺ → NAD⁺ + H₂O. Για την αντίδραση αυτή, η διαφορά στα αναγωγικά δυναμικά των δύο ημιαντιδράσεων (ΔE'°) είναι +1,14V. Η τιμή της μεταβολής της πρότυπης ελεύθερης ενέργειας (ΔG'°) είναι:
+110 kJ/mol
+220 kJ/mol
�110 kJ/mol
�220 kJ/mol
�55 kJ/mol
Για την αντίδραση As → H₂AsO₄⁻ + AsH₃ σε αλκαλικό περιβάλλον, οι συντελεστές ΜΟΝΟ των As, H₂AsO₄⁻ και AsH₃όταν αυτή ισοσταθμιστεί, είναι, με τη δοθείσα σειρά:
8, 2, 6
8, 5, 3
8, 3, 5
9, 5, 4
9, 4, 5
Εάν η ΔE'° για μια οξειδοαναγωγική αντίδραση είναι θετική, ποιο θα είναι το πρόσημο της ΔG'°;
Η ΔG'° θα είναι θετική
Η ΔG'° θα είναι αρνητική
Η ΔG'° θα είναι μηδέν
Το πρόσημο της ΔG'° δεν μπορεί να υπολογιστεί
Η ΔG'° θα είναι θετική για κάποιες θετικές τιμές της ΔE'° και αρνητική για κάποιες θετικές τιμές της ΔE'°
Η δεϋδρογόναση της 3-φωσφορικής γλυκερόλης καταλύει την ακόλουθη αντιστρέψιμη αντίδραση: 3-φωσφορική γλυκερόλη + NAD⁺ → NADH + H⁺ + φωσφορική διϋδροξυακετόνη. Δεδομένων των πρότυπων αναγωγικών δυναμικών που δίνονται πιο κάτω, να υπολογίσετε τη ΔG'° για την αντίδραση της δεϋδρογονάσης της 3-φωσφορικής γλυκερόλης, από τα αριστερά προς τα δεξιά, όπως δίνεται. Οι αντιδράσεις είναι: ① Φωσφορική διϋδροξυακετόνη + 2e⁻ + H⁺ → 3-φωσφορική γλυκερόλη (ΔE'° = −0,29V) και ② NAD⁺ + H⁺ + 2e⁻ → NADH (ΔE'° = −0,32V). Δίνεται η σταθερά Faraday = 96.48 kJ/V·mol
ΔG'° = +5,8 kJ/mol
ΔG'° = −3,9 kJ/mol
Η ΔG'° δεν μπορεί να υπολογιστεί από τα δεδομένα
ΔG'° = −5,8 kJ/mol
ΔG'° = +3,9 kJ/mol
Η δεϋδρογόναση του γαλακτικού καταλύει την ακόλουθη αντιστρέψιμη αντίδραση: πυροσταφυλικό + NADH + H⁺ → γαλακτικό + NAD⁺. Δεδομένης της ανάμειξης NAD⁺, NADH, πυροσταφυλικού και γαλακτικού, όλα σε 1Μ συγκέντρωση, ποια θα είναι η τιμή της ΔG'° για την αντίδραση αυτή; Οι επιμέρους αντιδράσεις είναι: ① NAD⁺ + H⁺ + 2e⁻ → NADH (ΔE'° = −0,32V) και ② Πυροσταφυλικό + 2H⁺ + 2e⁻ → γαλακτικό (ΔE'° = −0,19V). Δίνεται η σταθερά Faraday = 96.48 kJ/V·mol
ΔG'° = +12,6 kJ/mol
ΔG'° = +25,1 kJ/mol
ΔG'° = −12,6 kJ/mol
ΔG'° = −25,1 kJ/mol
Η ΔG'° δεν μπορεί να υπολογιστεί από τα δεδομένα
Η αλκοολική αφυδρογονάση καταλύει την ακόλουθη αντιστρέψιμη αντίδραση: Ακεταλδεΰδη + NADH + H⁺ → αιθανόλη + NAD⁺. Δίνονται οι αντιδράσεις ① Ακεταλδεΰδη + 2H⁺ + 2e⁻ → αιθανόλη (ΔE'° = −0,20V) και ② NAD⁺ + H⁺ + 2e⁻ → NADH (ΔE'° = −0,32V). Δίνεται η σταθερά Faraday = 96.48 kJ/V·mol. Η τιμή της ΔG'° για την πρώτη αντίδραση είναι:
ΔG'° = +11,6 kJ/mol
ΔG'° = +23,2 kJ/mol
ΔG'° = −11,6 kJ/mol
ΔG'° = −23,2 kJ/mol
Η ΔG'° δεν μπορεί να υπολογιστεί από τα δεδομένα
Σε ένα κλειστό σύστημα μεταφέρεται/ονται:
Ύλη και ενέργεια
Ύλη αλλά όχι ενέργεια
Ενέργεια αλλά όχι ύλη
Ούτε ύλη ούτε ενέργεια
Ενέργεια, και η μεταφορά της ύλης εξαρτάται από πολλούς παράγοντες
Ποια από τις παρακάτω καταστατικές συναρτήσεις (state functions) δεν είναι εκτατική (extensive)ή;
E (εσωτερική ενέργεια)
T (θερμοκρασία)
H (ενθαλπία)
S (εντροπία)
G (ελεύθερη ενέργεια κατά Gibbs)
Σύμφωνα με το Δεύτερο Νόμο της Θερμοδυναμικής:
Η συνολική ενέργεια παραμένει σταθερή, δεν δημιουργείται ούτε καταστρέφεται, αλλά μετασχηματίζεται από τη μια μορφή στην άλλη.
Όταν μια χημική αντίδραση μπορεί να γραφεί ως άθροισμα δύο ή περισσοτέρων αντιδράσεων, τότε η μεταβολή της ενθαλπίας της συνολικής αντίδρασης ισούται με το άθροισμα των μεταβολών ενθαλπίας των επιμέρους αντιδράσεων
Όταν δύο θερμοδυναμικά συστήματα είναι σε θερμική ισορροπία με ένα τρίτο, τότε είναι και μεταξύ τους
Η ολική εντροπία του σύμπαντος (συστήματος και περιβάλλοντος) αυξάνεται πάντοτε σε μια αυθόρμητη διαδικασία (ΔSολική > 0)
Στο απόλυτο μηδέν, επικρατεί πλήρης τάξη και η εντροπία μιας απόλυτα καθαρής ουσίας είναι μηδέν (W → 0)
Σύστημα κυλίνδρου-εμβόλου θερμαίνεται μέσω εξωτερικής φλόγας με 559J. Τα περιεχόμενα του κυλίνδρου διαστέλλονται πιέζοντας το έμβολο προς τα έξω και παράγουν έργο 488J. Η τιμή της ΔE είναι:
ΔE = +1047J
ΔE = −1047J
ΔE = +71J
ΔE = −71J
Η ΔE δεν μπορεί να υπολογιστεί από τα δεδομένα
Όταν 1,010g ζάχαρης (ΜΒ =342,3) καίγονται σε αδιαβατικό θερμιδόμετρο και αυξάνουν τη θερμοκρασία από 24,92°C σε 28,33°C (Cθερμιδομέτρου =4,90 kJ/°C), τότε η τιμή της ΔEαντ είναι:
ΔE = +16,7 kJ/mol
ΔE = −16,7 kJ/mol
ΔE = +5,66·10³ kJ/mol
ΔE = −5,66·10³ kJ/mol
Η ΔE δεν μπορεί να υπολογιστεί από τα δεδομένα
Όταν καίγεται καύσιμο σε έναν κύλινδρο εξοπλισμένο με ένα έμβολο, ο όγκος διαστέλλεται από 0,255 σε 1,45 λίτρα έναντι μιας εξωτερικής πίεσης 1,02 atm. Επιπλέον, εκπέμπονται 875J ως θερμότητα. Εάν 1L·atm = 101,3J, Η τιμή της ΔE είναι:
ΔE = +123,47J
ΔE = −123,47J
ΔE = +998J
ΔE = −998J
ΔE = − 751,53J
Ένα ιδανικό αέριο διαστέλλεται από όγκο 6dm³ σε 16dm³ υπό σταθερή εξωτερική πίεση 2,026·10⁵ N/m². Εάν η ΔE = 418J, τότε η μεταβολή της ενθαλπίας είναι:
ΔH = +2026J
ΔH = −2026J
ΔH = +2444J
ΔH = −2444J
ΔH = +418J
Να υπολογίσετε το έργο που πραγματοποιείται στην ακόλουθη αντίδραση, όταν χρησιμοποιούνται 2 mol HCℓ υπό σταθερή πίεση και θερμοκρασία 150°C: 4HCℓ(g) + O₂(g) → 2Cℓ₂(g) + 2H₂O(g). Δίνεται R = 8,314 J/K·mol.
W = +3516J
W = −3516J
W = +1758J
W = −1758J
W = +7031J
Να υπολογίσετε το έργο που πραγματοποιείται στην ακόλουθη αντίδραση, όταν 2 mol NH₄NO₃ αποσυντίθενται υπό σταθερή πίεση στους 100°C: NH₄NO₃(s) → N₂O(g) + 2H₂O(g). Δίνεται R = 8,314 J/K·mol.
W = + 12,4 kJ
W = −12,4 kJ
W = + 18,61 kJ
W = − 18,61kJ
W = − 5,0 kJ
Το CO αντιδρά με το O₂ σύμφωνα με την αντίδραση: 2CO(g) + O₂(g) → 2CO₂(g) [ΔH = -566kJ]. Ποια είναι η τιμή της ΔE για την αντίδραση 7,0g CO υπό πίεση 1 atm, εάν ο όγκος ελαττώνεται κατά 2,8L;
ΔE = −283,6 J
ΔE = +283,6J
ΔE = −70,47 kJ
ΔE = +70,47 kJ
ΔE = −70,75 kJ
Δείγμα οκτανίου (C₈H₁₈) καίγεται σε θερμιδόμετρο τύπου οβίδας που περιέχει 1200g νερού, σε αρχική θερμοκρασία 25,00°C. Μετά την αντίδραση, η τελική θερμοκρασία του νερού είναι 33,20°C. Η θερμοχωρητικότητα του θερμιδομέτρου είναι 837 J/°C και η ειδική θερμοχωρητικότητα του νερού είναι 4,184 J/g°C. Οι ατομικές μάζες των στοιχείων C = 12 και H = 1. Η θερμότητα καύσης του οκτανίου σε kJ/mol είναι:
+48,1 kJ/mol
�48,1 kJ/mol
+5483 kJ/mol
�5483 kJ/mol
+ 41,2 kJ/mol
Η μεταβολή της ενθαλπίας (ΔH) μιας αντίδρασης εξαρτάται από όλα τα παρακάτω εκτός από:
Τη φύση των αντιδρώντων
Τη φυσική κατάσταση των αντιδρώντων και των προϊόντων
Τη θερμοκρασία
Την πίεση
Κανένα από τα παραπάνω
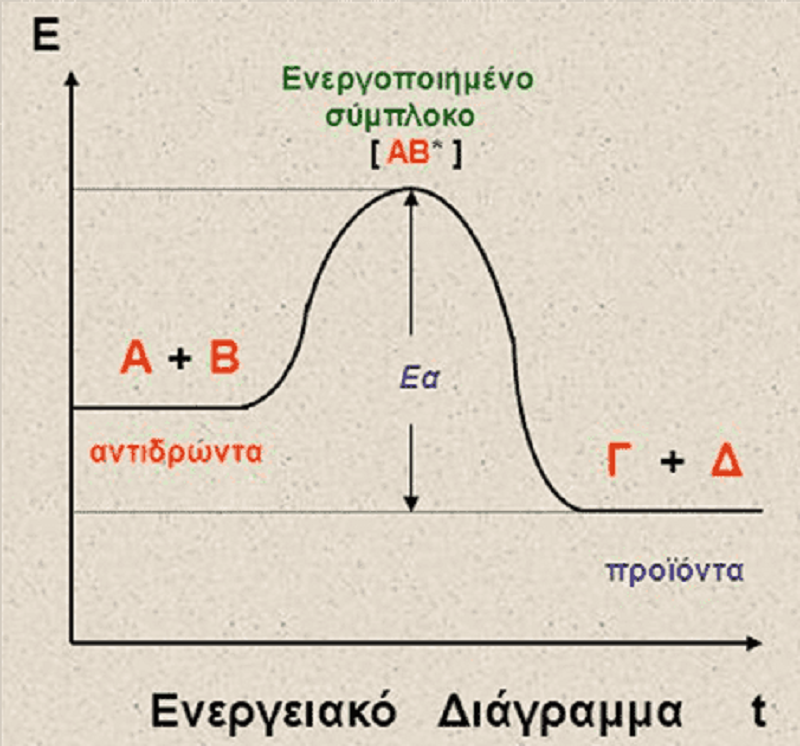
Για την πιο πάνω αντίδραση, ισχύει:
Είναι ενδόθερμη
ΔEσυστ >0
ΔEπεριβ < 0
ΔEολική = 0
Η ενέργεια ενεργοποίησης είναι μηδενική
Στους 25°C, η αντίδραση 2CO(g) + O₂(g) → 2CO₂(g) [ΔH = −566 kJ] πραγματοποιείται με ΔE:
ΔE = −568,48 kJ
ΔE = −566 kJ
ΔE = −563,52 kJ
ΔE = +566 kJ
ΔE = +563,52 kJ
Υπό σταθερή πίεση 1 atm, 1,8g H₂O απαιτούν θερμότητα 4,1kJ για να εξατμιστούν (100°C) πλήρως, σύμφωνα με την αντίδραση H₂O(ℓ) → H₂O(g). Ποια είναι η ΔE της αντίδρασης;
ΔE = −41 kJ
ΔE = +41 kJ
ΔE = −3,1 kJ
ΔE = −37,9 kJ
ΔE = +37,9 kJ
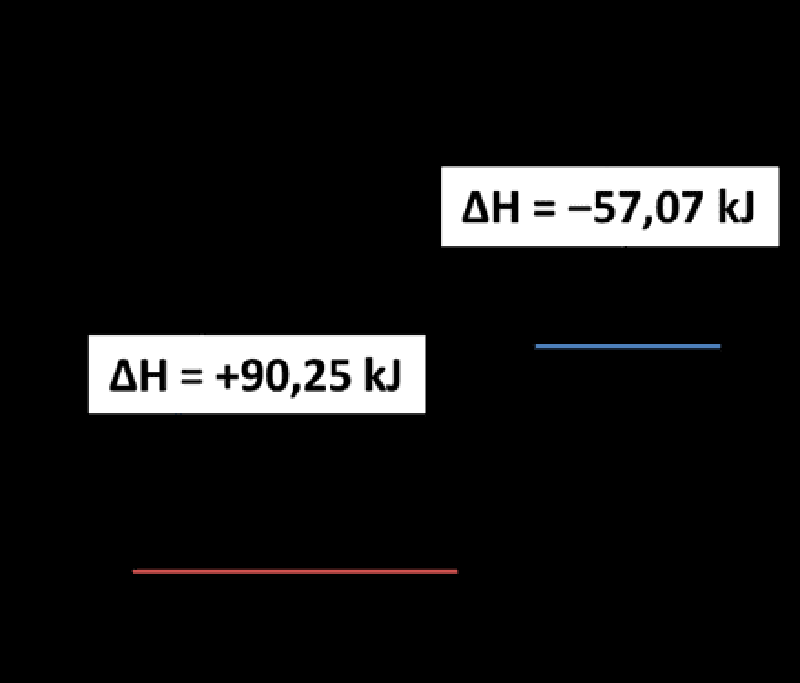
Για την αντίδραση ½N₂(g) + O₂(g) → NO₂(g), η ΔH είναι:
ΔH = +33,18 kJ
ΔH = −33,18 kJ
ΔH = +147,32 kJ
ΔH = −147,32 kJ
Κανένα από τα πιο πάνω
Τι ισχύει για την ενθαλπία;
Είναι μόνο καταστατική ιδιότητα
Είναι μόνο εκτατική ιδιότητα
Είναι και καταστατική και εκτατική ιδιότητα
Δεν είναι ούτε καταστατική ούτε εκτατική ιδιότητα
Η μεταβολή της εξαρτάται από το μηχανισμό της αντίδρασης
Ποια από τις παρακάτω προτάσεις για τις πρότυπες καταστάσεις και ενθαλπίες είναι λανθασμένη;
Στις πρότυπες καταστάσεις, συνήθως η θερμοκρασία είναι 25°C = 298K
Στις πρότυπες καταστάσεις, για καθαρό αέριο η πίεση θα πρέπει να είναι 1 atm
Στις πρότυπες συνθήκες, οι ουσίες σε διαλύματα θα πρέπει να βρίσκονται σε συγκέντρωση 1Μ
Η ΔH°σχημ είναι η μεταβολή της ενθαλπίας όταν αντιδρά 1 mol συστατικών στοιχείων και δίνει καθαρή ένωση
Για ένα καθαρό στοιχείο στην πρότυπη κατάσταση, ισχύει ΔH°σχημ =0 kJ/mol
Ένα μπουκάλι των 500mL με νερό σε θερμοκρασία δωματίου και ένα μπουκάλι των 2L με νερό στην ίδια θερμοκρασία, τοποθετήθηκαν σε ένα ψυγείο. Μετά από 30 λεπτά, το μπουκάλι των 500mL ψύχθηκε στη θερμοκρασία του ψυγείου. Μια ώρα μετά, το μπουκάλι των 2L ψύχθηκε στην ίδια θερμοκρασία. Ποια από τις ακόλουθες δηλώσεις αληθεύει;
Και τα δύο μπουκάλια έχασαν το ίδιο ποσό θερμότητας διότι ξεκίνησαν στην ίδια θερμοκρασία και κατέληξαν στην ίδια θερμοκρασία
Το μπουκάλι των 2L έχασε περισσότερη θερμότητα διότι σε αυτό υπήρχε περισσότερο νερό
Το μπουκάλι των 500mL έχασε περισσότερη θερμότητα διότι ψύχθηκε γρηγορότερα
Δεν μπορούμε να γνωρίζουμε ποιο μπουκάλι έχασε την περισσότερη θερμότητα διότι δεν γνωρίζουμε την αρχική και την τελική θερμοκρασία του νερού
Άλλη απάντηση
Πόσα mL νερού στους 23°C με πυκνότητα 1,00 g/mL πρέπει να αναμειχθούν με 180mL καφέ στους 95°C ώστε να προκύψει διάλυμα με θερμοκρασία 60°C; Υποθέστε ότι το νερό και ο καφές έχουν την ίδια πυκνότητα και την ίδια ειδική θερμοχωρητικότητα (4,184 J/g°C)
130mL
150mL
170mL
190mL
210mL
Όταν 50,0g διαλύματος NaCℓ συγκέντρωσης 0,200Μ στους 24,1°C προστίθεται σε 100,0g διαλύματος AgNO₃ συγκέντρωσης 0,100Μ στους 24,1°C σε θερμιδόμετρο, η θερμοκρασία αυξάνεται στους 25,2°C καθώς σχηματίζεται στερεό AgCℓ. Υποθέτοντας ότι η ειδική θερμοχωρητικότητα του διαλύματος και των προϊόντων είναι 4,20J/g°C, το ποσό της θερμότητας που παράγεται είναι περίπου:
600J
700J
800J
900J
1000J
Ένα ζαχαρωτό περιέχει 2,67g σουκρόζης (C₁₂H₂₂O₁₁). Όταν η ποσότητα αυτή αντιδράσει με 7,19g KCℓO₃, παράγονται 43,7kJ θερμότητας. Η μεταβολή της ενθαλπίας για την αντίδραση: C₁₂H₂₂O₁₁(aq) + 8KCℓO₃(aq) → 12CO₂(g) + 11H₂O(ℓ) + 8KCℓ(aq) είναι:
�745 kJ
�5960 kJ
�5600 kJ
+2980 kJ
+2800 kJ
Το όζον σχηματίζεται από το οξυγόνο μέσω μιας ενδόθερμης διαδικασία. Η πηγή της ενέργειας που οδηγεί αυτήν την αντίδραση είναι η υπεριώδης ακτινοβολία στην ανώτερη ατμόσφαιρα. Υποθέτοντας ότι τα αντιδρώντα και τα προϊόντα στην αντίδραση 3O₂(g) → 2O₃(g) [ΔH° = +286 kJ], η πρότυπη ενθαλπία σχηματισμού του όζοντος είναι:
ΔH°σχημ = +286 kJ
ΔH°σχημ = −286 kJ
ΔH°σχημ = +143 kJ
ΔH°σχημ = −143 kJ
ΔH°σχημ = 0 διότι αποτελείται μόνο από ένα είδος ατόμου
Το μονοφθοριούχο χλώριο μπορεί να αντιδράσει με το χλώριο για να σχηματίσει τριφθοριούχο χλώριο σύμφωνα με την αντίδραση (i): CℓF(g) + F₂(g) → CℓF₃(g). Χρησιμοποιώντας τις αντιδράσεις (ii): 2OF₂(g) → O₂(g) + 2F₂(g) [ΔH°₍ᵢᵢ₎ = −49,4 kJ], (iii): 2CℓF(g) + O₂(g) → Cℓ₂O(g) + OF₂(g) [ΔH°₍ᵢᵢᵢ₎ = +205,6 kJ] και (iv): CℓF₃(g) + O₂(g) → ½Cℓ₂O(g) + ³/₂OF₂(g) [ΔH°₍ᵢᵥ₎ = +266,7 kJ]. Να υπολογίσετε τη ΔH° της αντίδρασης (i).
ΔH°₍ᵢ₎ = −422.9 kJ
ΔH°₍ᵢ₎ = +422.9 kJ
ΔH°₍ᵢ₎ = −139.2 kJ
ΔH°₍ᵢ₎ = +139.2 kJ
Άλλη απάντηση
To AℓCℓ₃ μπορεί να σχηματιστεί σύμφωνα με την αντίδραση (i): 2Aℓ(s) + 3Cℓ₂(g) → 2AℓCℓ₃(s). Χρησιμοποιώντας τις αντιδράσεις (ii): HCℓ(g) → HCℓ(aq) [ΔH°₍ᵢᵢ₎ = −74,8 kJ], (iii): H₂(g) + Cℓ₂(g) → 2HCℓ(g) [ΔH°₍ᵢᵢᵢ₎ = −185 kJ], (iv): AℓCℓ₃(aq) → AℓCℓ₃(s) [ΔH°₍ᵢᵥ₎ = +323 kJ], και (v): 2Aℓ(s) + 6HCℓ(aq) → 2AℓCℓ₃(aq) + 3H₂(g) [ΔH°₍ᵥ₎ = −1049 kJ]. Να υπολογίσετε τη ΔH° της αντίδρασης (i).
ΔH°₍ᵢ₎ = −63,2 kJ
ΔH°₍ᵢ₎ = +63,2 kJ
ΔH°₍ᵢ₎ = −1407 kJ
ΔH°₍ᵢ₎ = +1407 kJ
Άλλη απάντηση
Να υπολογίσετε τη ΔH° της αντίδρασης καύσης 1 mol αιθανόλης, C₂H₅OH(ℓ), όταν σχηματίζονται H₂O(ℓ) και CO₂(g). Δίνονται οι ενθαλπίες σχηματισμού: C₂H₅OH(ℓ): −278 kJ, H₂O(ℓ): −286 kJ και CO₂(g): −394 kJ
+1368 kJ
�1368 kJ
+402 kJ
�402 kJ
Άλλη απάντηση
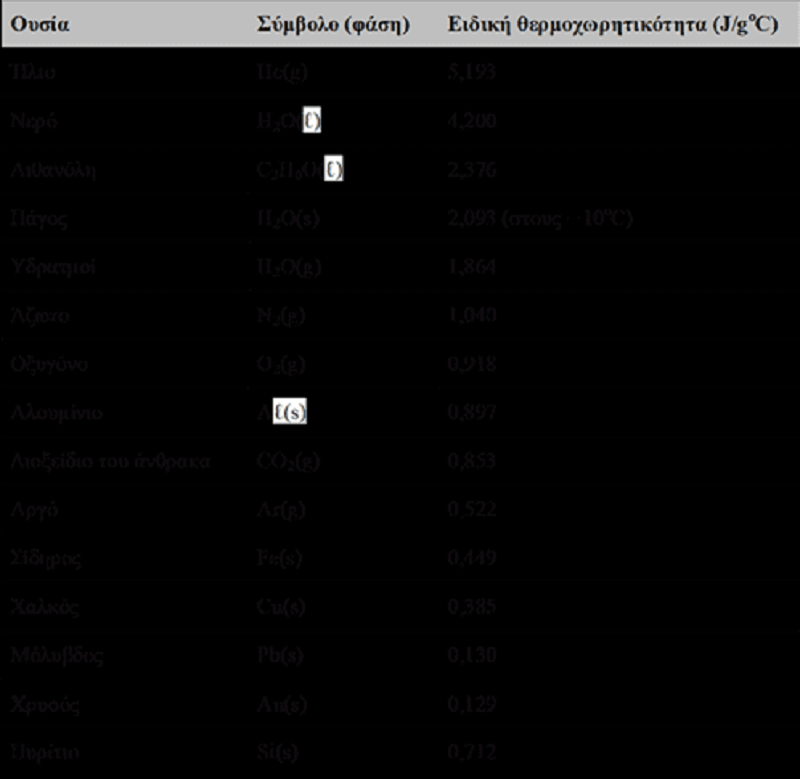
Στον παραπάνω πίνακα, παρουσιάζονται οι ειδικές θερμοχωρητικότητες για ορισμένες ουσίες. Ένα κομμάτι μετάλλου, μάζας 59,5g, το οποίο είχε βυθιστεί σε βραστό νερό, μεταφέρθηκε γρήγορα σε 60,0mL νερού, αρχικής θερμοκρασίας 22,0°C. Η τελική θερμοκρασία ανήλθε στους 28,5°C. Με βάση τα πιο πάνω στοιχεία, συμπεραίνεται ότι το μέταλλο είναι:
Fe(s)
Cu(s)
Pb(s)
Au(s)
Si(s)

Η θερμοδυναμική πιθανότητα W για 1 mol αερίου προπανίου (CH₃CH₂CH₃) στους 500K και σε πίεση 101,3 kPa έχει την τιμή που παρουσιάζεται πιο πάνω. Υπό τις συνθήκες αυτές, η εντροπία του αερίου είναι:
123 J/K
267 J/K
318 J/K
416 J/K
522 J/K
Ποιας από τις ακόλουθες αντιδράσεις δεν μπορούμε να προβλέψουμε χωρίς πίνακες το πρόσημο της μεταβολής της εντροπίας;
Cℓ₂(g) → Cℓ₂(ℓ)
CaCO₃(s) → CaO(s) + CO₂(g)
N₂(g) + 3H₂(g) → 2NH₃(g)
AgNO₃(aq) + NaCℓ(aq) → NaNO₃(aq) + AgCℓ
H₂(g) + Cℓ₂(g) → 2HCℓ(g)
Μια γυναίκα βρίσκεται στην κουζίνα του σπιτιού της ένα απόγευμα, και ενώ μαγειρεύει για βραδινό, φτιάχνει τσάι για την ίδια και ποπ κορν για τα παιδιά της που παρακολουθούν μια ταινία στο σαλόνι. Έχει βάλει το νερό να βράσει για το τσάι που θα πιει, και έχει διαλύσει σε νερό ζάχαρη και αλάτι για το φαγητό. Αφού έβαλε το ποπ κορν στο φούρνο μικροκυμάτων για να ετοιμαστεί, παρατήρησε πως μέσα σε όλο αυτό το τρέξιμο για να τα ετοιμάσει όλα, είχε αφήσει στο τραπέζι την παγοθήκη με τις παγοκυψέλες που έβγαλε από το ψυγείο για να πάρει κάποια υλικά για το φαγητό. Έτσι, επανατοποθέτησε την παγοθήκη με τα λιωμένα παγάκια μέσα στο ψυγείο, και συνέχισε τις δουλειές της. Από τα πιο πάνω, ποιο δεν αποτελεί παράδειγμα αύξησης της εντροπίας στην κουζίνα;
Το λιώσιμο του πάγου
Η διάλυση του αλατιού και της ζάχαρης
Η ετοιμασία του ποπ κορν στο φούρνο μικροκυμάτων
Το βράσιμο του νερού για το τσάι
Η ψύξη του νερού σε παγάκια
Η απόλυτη εντροπία ενός μορίου αυξάνει:
Με αύξηση του μεγέθους και ελάττωση της πολυπλοκότητάς του
Με ελάττωση του μεγέθους και αύξηση της πολυπλοκότητάς του
Με αύξηση του μεγέθους και της πολυπλοκότητάς του
Με ελάττωση του μεγέθους και της πολυπλοκότητάς του
Άλλη απάντηση

Στον παραπάνω πίνακα δίνονται τέσσερις αντιδράσεις Α, Β, Γ, και Δ, και τα πρόσημα των μεταβολών της εντροπίας και της ενθαλπίας σε κάθε περίπτωση. Σε ποια από τις τέσσερις περιπτώσεις η αντίδραση δεν μπορεί να είναι ποτέ αυθόρμητη;
Α
Β
Γ
Δ
Όλες οι αντιδράσεις είναι αυθόρμητες σε κάποια θερμοκρασία
Το διοξείδιο του θείου αντιδρά με το οξυγόνο για να σχηματίσει τριοξείδιο του θείου, σύμφωνα με την αντίδραση 2SO₂(g) + O₂(g) ⇌ 2SO₃(g). Η σταθερά ισορροπίας Kₚ για την αντίδραση αυτή είναι 0,365 στους 1150K και η πρότυπη μεταβολή της ενθαλπίας είναι −198 kJ/mol. Χρησιμοποιώντας την εξίσωση του Van't Hoff, να υπολογίσετε τη σταθερά ισορροπίας της δεδομένης αντίδρασης στους 1260K.
16,7
0,06
2,23
0,123
0,0167

Ένα νέο απορροφητικό από φλούδα πορτοκαλιού που δημιουργήθηκε με επεξεργασία αγροτικού λυματικού υλικού, χρησιμοποιήθηκε για την αφαίρεση βαφής Remazol Brilliant Blue (RBBR) από τεχνητά κλωστοϋφαντουργικά προϊόντα. Η θερμοδυναμική απορρόφηση μελετήθηκε με μια σειρά πειραμάτων χημικής ισορροπίας. Ο χρόνος που χρειάστηκε για να επιτευχθεί η ισορροπία ήταν 15 ώρες για συγκέντρωση εύρους 30mg/L - 250mg/L. Η δυνατότητα απορρόφησης μειώθηκε με την αύξηση της θερμοκρασίας, από τα 9,7mg/L στους 20°C στα 5,0mg στους 60°C. Η θερμοδυναμική ανάλυση της απορρόφησης της βαφής στο προσροφητικό της φλούδας πορτοκαλιού υπέδειξε την ενδοθερμική και αυθόρμητη φύση της αντίδρασης. Στην παραπάνω γραφική παράσταση, παρουσιάζεται ο λογάριθμος της σταθεράς ισορροπίας της αντίδρασης σε συνάρτηση με το αντίστροφο της θερμοκρασίας στην οποία εκτελέστηκε το πείραμα. Από τις μετρήσεις που λήφθηκαν, χαράχθηκε η κατάλληλη γραφική παράσταση, που αντιστοιχεί σε ευθεία γραμμή με τη δοθείσα εξίσωση. Από τα δεδομένα του σχήματος, ποιες είναι οι τιμές των ΔH° και ΔS° της αντίδρασης απορρόφησης της RBBR;
ΔH° = +2744,7 J και ΔS° = +14,93 J/mol·K
ΔH° = +22,82 kJ/mol και ΔS° = +14,93 J/mol·K
ΔH° = +2744,7 J και ΔS° = 124,1 J/mol·K
ΔH° = +22,82 και ΔS° = 124,1 J/mol·K
ΔH° = −2744,7 J και ΔS° = +14,93 J/mol·K
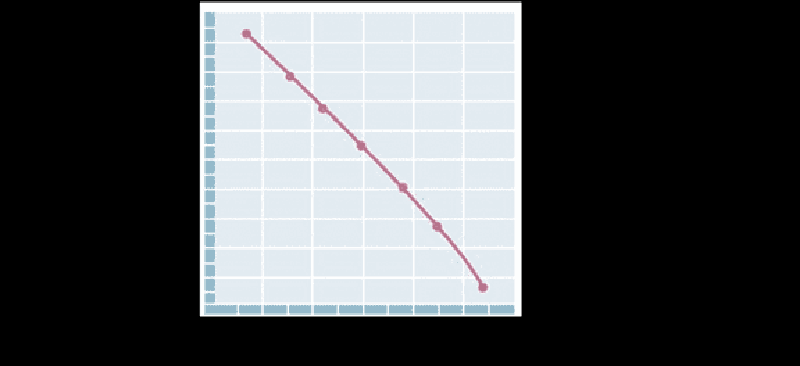
Η πιο πάνω γραφική παράσταση αναφέρεται στην αντίδραση αποδιάταξης του χυμοθρυψινογόνου σε pH = 7, από την ενεργό μορφη (N) στην αποδιαταγμένη μορφή (D) σύμφωνα με την ισορροπία N(aq) ⇌ D(aq). Με βάση τα δεδομένα, στους 53°C, η ποσότητα του ενεργού (N) σε σχέση με το αποδιαταγμένο (D) ένζυμο είναι περίπου:
Ίση, [N] ≅ [D]
Υποδεκαπλάσια, [N] ≅ ⅒[D]
Εικοσαπλάσια, [N] ≅ 20[D]
Εννιαπλάσια, [N] ≅ 9[D]
Δεκαοκταπλάσια, [N] ≅ 18[D]
Δίνονται οι ενώσεις (Α): CH₃OH(s), (Β): CH₃OH(ℓ), (Γ): CH₃OH(g) και (Δ): CH₃CH₂OH(g). Να τις κατατάξετε κατά σειρά αύξουσας εντροπίας.
Α, Δ, Γ, Β
Α, Β, Δ, Γ
Α, Β, Γ, Δ
Δ, Γ, Β, Α
Γ, Δ, Β, Α
Δίνονται οι αντιδράσεις (1): H₂SO₄(ℓ, 1atm) → H₂SO₄(s, 1atm), (2): H₂O(ℓ, 1atm) → H₂O(g, 1atm) και (3): CH₄(g) + 2O₂(g) ⇌ CO₂(g) + 2H₂O(ℓ). Οι μεταβολές της εντροπίας των αντιδράσεων είναι, αντίστοιχα:
(1): Αύξηση, (2): Μείωση, (3): Αύξηση
(1): Αύξηση, (2): Μείωση, (3): Μείωση
(1): Αύξηση, (2): Αύξηση, (3): Μείωση
(1): Μείωση, (2): Μείωση, (3): Αύξηση
(1): Μείωση, (2): Αύξηση, (3): Μείωση
Για την αντίδραση 2CO(g) + O₂(g) → 2CO₂(g) στους 298,15K δίνονται ΔH° = −128,3 kJ και ΔS° = −159,5 J/K. Η τιμή της ΔG° είναι:
ΔG° = −80,75 kJ
ΔG° = −175,85 kJ
ΔG° = −161,5 kJ
ΔG° = +209,0 kJ
ΔG° = +223,4 kJ
Για την αντίδραση H₂SO₄(aq) + H₂O(ℓ) ⇌ H₃O⁺(aq) + HSO₄⁻(aq) η ΔG° = +31,43 kJ/mol στους 298,15K. Σε κάποια χρονική στιγμή που οι συγκεντρώσεις των ουσιών είναι [H₂SO₄(aq)] = 0,2M, [H₃O⁺(aq)] = 0,1M και [HSO₄⁻(aq)] = 0,1M, ποια είναι η τιμή της ΔG;
ΔG = −35,42 kJ
ΔG = +24,0 kJ
ΔG = +35,42 kJ
ΔG = +31,43 kJ
ΔG = +38,86 kJ

Για αντιδράσεις που περιλαμβάνουν μόνο αέρια, ποια από τις παραπάνω εξισώσεις είναι λανθασμένη;
Α
Β
Γ
Δ
Καμία από τις παραπάνω
Δίνεται η αντίδραση διάσπασης της αμμωνίας στα συστατικά της: 2NH₃(g) ⇌ 3H₂(g) + N₂(g). Στους 25°C, η αντίδραση έχει ΔG° = +33,0 kJ/mol και οι μερικές πιέσεις των αερίων είναι P(N₂) = 0,870 atm και P(NH₃) = 12,9 atm. Η μερική πίεση του υδρογόνου είναι:
P(H₂) = 0,250 atm
P(H₂) = 0,500 atm
P(H₂) = 0,750 atm
P(H₂) = 8,25 atm
P(H₂) = 9,75 atm
Σε ένα δοχείο όγκου V εισάγονται στους 25°C, 0,07 mol NO₂ και 0,14 mol N₂O₄. Όταν επέλθει ισορροπία σύμφωνα με την αντίδραση N₂O₄(g) ⇌ 2NO₂(g), η ΔG° της αντίδρασης υπολογίζεται ίση με +4871J. Ο όγκος του δοχείου είναι:
120 mL
250 mL
330 mL
760 mL
980 mL
Στους 25°C, η σταθερά ισορροπίας (Kw) για τον αυτοϊοντισμό του νερού είναι 1,00·10⁻¹⁴. Ποιά είναι η τιμή της ΔG° της αντίδρασης παραγωγής του νερού από τα υδατικά ιόντα του;
+79,88 kJ
�79,88 kJ
+81,60 kJ
�81,60 kJ
Δεν μπορεί να υπολογιστεί από τα δεδομένα
Στο εργαστήριο, το υδροχλώριο, HCℓ(g), και η αμμωνία, NH₃(g), συχνά διαφεύγουν από τα δοχεία των διαλυμάτων τους και αντιδρούν προς σχηματισμό λευκών νεφών χλωριούχου αμμωνίου, NH₄Cℓ(s). Υποθέτοντας ότι ο αριθμός των mol κάθε αερίου που διαφεύγει στο χώρο από κάθε δοχείο είναι ο ίδιος, ποια είναι η μέγιστη μερική πίεση του υδροχλωρίου και της αμμωνίας στο εργαστήριο στους 25°C; Υποθέστε ότι οι μερικές πιέσεις είναι μέγιστες στην ισορροπία και ότι ΔG°(HCℓ) = −95,26 kJ, ΔG°(NH₃) = −16,43 kJ και ΔG°(NH₄Cℓ) = −202,97 kJ
1,2·10⁻⁹ atm
7,2·10⁻8 atm
1,0·10⁻8 atm
1,6·10⁻7 atm
1,4·10⁻6 atm

Το οξικό οξύ, CH₃COOH, μπορεί να σχηματίσει ένα διμερές, το (CH₃COOH)₂ σε αέρια κατάσταση, σύμφωνα με την εξίσωση 2CH₃COOH(g) → (CH₃COOH)₂(g). Το διμερές συγκρατείται από δύο δεσμούς υδρογόνου με συνολική ισχύ 65,45 kJ ανά mol διμερούς. Στους 25°C, η σταθερά ισορροπίας για το διμερισμό είναι 1,3·10³ (πίεση σε atm). Ποια είναι η τιμή της ΔS° για την αντίδραση αυτή;
ΔS° = +0,279 kJ/mol·K
ΔS° = −0,279 kJ/mol·K
ΔS° = +0,160 kJ/mol·K
ΔS° = −0,160 kJ/mol·K
ΔS° = −380 kJ/mol·K
Μια από τις σημαντικότερες αντιδράσεις στο βιοχημικό μονοπάτι της γλυκόλυσης είναι η αντίδραση της 6-φωσφορικής γλυκόζης (G6P) προς σχηματισμό 6-φωσφορικής φρουκτόζης (F6P) σύμφωνα με την αντίδραση: G6P(aq) ⇌ F6P(aq). Η πρότυπη μεταβολή της ελεύθερης ενέργειας για την αντίδραση αυτή είναι +1,7 kJ. Οι πρότυπες θερμοδυναμικές συνθήκες επιβάλλουν τις συγκεντρώσεις των δύο ουσιών να ανέρχονται στο 1M έκαστη, ωστόσο σε ένα τυπικό ανθρώπινο κύτταρο, δεν πλησιάζουν καν τι τιμές αυτές. Όταν στη θερμοκρασία του ανθρώπινου σώματος (37°C) η συγκέντρωση της 6-φωσφορικής φρουκτόζης είναι 28μM, η μεταβολή της ελεύθερης ενέργειας για την αντίδραση υπολογίζεται στα 2,05 kJ και είναι εξεργονική. Να υπολογίσετε τη συγκέντρωση της 6-φωσφορικής γλυκόζης στην πιο πάνω ισορροπια.
68μM
72μM
94μM
120μM
150μM
Όταν το χλωριούχο αμμώνιο διαλύεται στο νερό και αναδεύεται, διαλύεται αυθόρμητα και το σχηματιζόμενο διάλυμα είναι κρύο (όπως αποκαλύπτει το άγγιγμα του δοκιμαστικού σωλήνα). Χωρίς να εκτελέσετε οποιουσδήποτε υπολογισμούς, να καθορίσετε τα πρόσημα των ΔG, ΔH και ΔS.
ΔG > 0, ΔH > 0 και ΔS > 0
ΔG < 0, ΔH < 0 και ΔS < 0
ΔG < 0, ΔH > 0 και ΔS > 0
ΔG > 0, ΔH > 0 και ΔS < 0
ΔG < 0, ΔH < 0 και ΔS > 0
Σε ποια οριακή θερμοκρασία ευνοεί μια συγκεκριμένη αντίδραση το σχηματισμό των προϊόντων στην ισορροπία εάν ΔHº = +217.3 kJ/mol and ΔSº = +348.8 J/mol·K;
150ºC
280ºC
350ºC
420ºC
510ºC
Θεωρούμε την αντίδραση: A(aq) ⇌ B(aq), στους 25ºC με ΔGº = x. Κρατώντας τη θερμοκρασία και τη συγκέντρωση της Α σταθερή, προκαλούμε τέτοια ενεργειακή μεταβολή, που η καινούρια ΔGº της αντίδρασης είναι κατά 5154J μικρότερη (πιο αρνητική) από την αρχική. Τι θα συμβεί στη συγκέντρωση της Β στην καινούρια ισορροπία που θα επέλθει, σε σχέση με την αρχική συγκέντρωση;
Θα δεκαεξαπλασιαστεί
Θα τετραπλασιαστεί
Θα οκταπλασιαστεί
Θα υποδιπλασιαστεί
Θα υποτετραπλασιαστεί
Ποιος από τους παρακάτω λόγους δεν ερμηνεύει τη μεγάλη ΔG της υδρόλυσης ATP σε σχέση με έναν απλό φωσφορικό εστέρα;
Στο αρχικό μόριο (ATP)⁴⁻ υπάρχει μεγάλη ηλεκτροστατική άπωση
Το ATP συνήθως δωρίζει την ενέργειά του με απλή υδρόλυση
Το παραγόμενο Pᵢ σταθεροποιείται με συντονισμό μεταξύ τεσσάρων διαφορετικών ορθοφωσφορικών μεσομερών μορφών, οι οποίες έχουν διαφορετική ηλεκτρονιακή κατανομή
Το παραγόμενο ADP ιοντίζεται αμέσως, απελευθερώνοντας ένα H⁺ (σε pH = 7)
Ο βαθμός επιδιαλύτωσης των προϊόντων της υδρόλυσης (ADP και Pᵢ) είναι μεγαλύτερος σε σχέση με του αντιδρώντος ATP
Ποια από τις παρακάτω διεργασίες δεν αποτελεί υδρόλυση του ATP (ή GTP), αλλά μεταφορά ομάδας;
Μετακίνηση ενζύμων στο DNA ή ριβοσωμάτων στο RNA
Σύνθεση γλουταίνης από τη γλουταμινική συνθάση
Ξετύλιγμα της διπλής έλικας του DNA σε εσωτερικά σημεία του χρωμοσώματος από την ελικάση
Χαλάρωση της τάσης του υπερελικωμένου DNA μέσω τομής κατά την αντιγραφή, από την τοποϊσομεράση
Δράση μοριακού διακόπτη μιας ενδοκυττάριας G-πρωτεΐνης
Δίνεται σχηματικά η δομή του ATP, με σημειωμένους τρεις δεσμούς, τους X, Y και Z. Ποιοι από αυτούς είναι φωσφοανυδριτικοί και ποιοι φωσφοεστερικοί;
Όλοι είναι φωσφοεστερικοί
Φωσφοεστερικοί οι X και Y και φωσφοανυδριτικός ο Z
Φωσφοανυδριτικοί οι X και Y και φωσφοεστερικός ο Z
Όλοι είναι φωσφοανυδριτικοί
Φωσφοεστερικός ο X και φωσφοανυδριτικοί οι Y και Z

Στην παραπάνω εικόνα, παρουσιάζεται το μόριο του ATP, το οποίο δέχεται επίθεση από ένα πυρηνόφιλο ιόν (R¹⁸Ö) σε δύο πιθανές θέσεις. Ποια από τις ακόλουθες δηλώσεις είναι ορθή;
Υδρολύεται ο φωσφοεστερικός δεσμός μεταξύ α-β φωσφόρου
Η αντίδραση μπορεί απλουστευμένα να παρασταθεί ως ATP → ADP + Pᵢ
Στη μια περίπτωση, μεταφέρεται φωσφορυλική ομάδα, αλλά όχι φωσφορική
Μπορεί να μεταφερθεί αδενυλική ομάδα, π.χ. κατά την ενεργοποίηση λιπαρών οξέων
Η υδρόλυση του δεσμού αυτού απελευθερώνει λιγότερη ενέργεια από την αντίστοιχη του δεύτερου μεταξύ β-γφωσφόρου
Οι παρακάτω δηλώσεις αναφέρονται στη λειτουργία ορισμένων ενζύμων (-άσες). Ποια από αυτές είναι λανθασμένη;
Η υδρόλυση του ανόργανου πυροφωσφορικού γίνεται με την πυροφωσφατάση
Η μετατροπή 2 μορίων ADP σε ATP και AMP γίνεται με την αδενυλική κινάση
Η αδενυλική κυκλάση παράγει cAMP και πυροφωσφορικό από ATP
Το cAMP αποκυκλοποιείται σε AMP με τη φωσφοδιεστεράση
Η ATPάση της μυοσίνης κατά τη μυϊκή συστολή προκαλεί μεταφορά φωσφορικής ομάδας από το ATP
Να επιλέξετε την ορθή δήλωση από τις πιο κάτω:
Η υδρόλυση του πυροφωσφορικού δίνει περισσότερη ενέργεια τόσο από την υδρόλυση του ATP σε ADP όσο και από την υδρόλυση του ATP σε AMP
Η φωσφοριβόζη συχνά δέχεται πυροφωσφορλυική ομάδα
Η υδρόλυση του ATP σε υδατικό διάλυμα γίνεται μέσω ενζύμων, διότι, ως ενδεργονική αντίδραση, δεν ευνοείται κινητικά
Η υδρόλυση του α-β φωσφοανυδρτικού δεσμού του ADP δίνει ισόποση ενέργεια με την υδρόλυση του α-β φωσφοανυδριτικού δεσμού στο ATP
Η υδρόλυση του φωσφοεστερικού δεσμού του AMP δίνει περισσότερη ενέργεια από την υδρόλυση των φωσφοανυδριτικών δεσμών στα ATP και ADP
Ποια από τις ακόλουθες προτάσεις είναι λανθασμένη;
Το UTP χρησιμοποιείται για την ενεργοποίηση σακχάρων
Η φωσφοκρεατίνη θεωρείται ένωση υψηλής ενέργειας
Το CTP χρησιμοποιείται για την ενεργοποίηση ενδιαμέσων στη βιοσύνθεση των φωσφολιπιδίων
Το GTP, μεταξύ άλλων, συνδέεται με τον κύκλο του Krebs
Η 6-φωσφορική γλυκόζη, λόγω της φωσφορικής ομάδας που φέρει στον 6-άνθρακα, μπορεί με υδρόλυση να ελευθερώσει ενέργεια, και γι αυτό κατατάσσεται στις ενώσεις υψηλής ενέργειας
Το μαγνήσιο είναι πολύ σημαντικό στοιχείο της ανθρώπινης διατροφής. Το σώμα ενός ενήλικα περιέχει περίπου 24 γραμμάρια μαγνησίου, με το 60% στο σκελετό, το 39% εντός των κυττάρων (20% στους σκελετικούς μύες) και το υπόλοιπο 1% εκτός των κυττάρων. Λόγω του δισθενούς κατιοντικού φορτίου του, το Mg²⁺ μπορεί να αλληλεπιδράσει ισχυρά με τα ιόντα του φωσφόρου, όπως εκείνα που βρίσκονται στο μόριο του ATP. Ποια από τις παρακάτω δηλώσεις, που αναφέρονται στη σχέση του μαγνησίου με τα βασικά ενεργειακά νομίσματα του κυττάρου, είναι λανθασμένη;
Το Mg²⁺ μειώνει το φορτίο των ATP και ADP
Στις πρότυπες συνθήκες, η συγκέντρωση του Mg²⁺ είναι 1M
Πολλά ένζυμα για να λειτουργήσουν απαιτούν συγκέντωση Mg²⁺ μεταξύ 5-10mM
Σε γενικές γραμμές, αύξηση της συγκέντρωσης του Mg²⁺ προκαλεί ελάττωση της ΔG'° του ATP
Στις πρότυπες συνθήκες, pMg = 3
Τι δεν ισχύει για την επίδραση του pH στη ΔG'° του ATP;
Α: Κατά μέσο όρο, αύξηση του pH συνεπάγεται ελάττωση του ΔG'° (περισσότερο αρνητικό)
Β: Για κάθε μονάδα αύξησης του pH ≥ 7, η ΔG'° μεταβάλλεται κατά περίπου 5,7kJ (1371cal)
Γ: Στα ανθρώπινα κύτταρα, σε εύρος pH 6-7, η επίδραση του pH στη ΔG'° είναι μικρή
Δ: Τα Α + Β
Ε: Κανένα από τα παραπάνω
Τι δεν αληθεύει για την υδρόλυση του φωσφοενολοπυροσταφυλικού;
Έχει ΔG'° μεγαλύτερη κατ' απόλυτη τιμή από τη ΔG'° υδρόλυσης του 1,3-διφωσφογλυκερινικού
Τα προϊόντα μπορούν να σταθεροποιηθούν με πυροσταφυλική κετοενολοταυτομέρεια
Τα προϊόντα μπορούν να σταθεροποιηθούν με συντονισμό στο Pᵢ
Έχει ΔG'° ≅ −61,9 kJ/mol
Συζεύγνυται με τη δημιουργία ATP μέσω της πυροσταφυλικής κινάσης
Κατά τη διάρκεια της άσκησης δεν:
Ενεργοποιείται πρώτα ο αερόβιος μεταβολισμός και μετά ο αναερόβιος
Δρα η κρεατινική κινάση στις διεργασίες αποφωσφορυλίωσης της φωσφοκρεατίνης
Παράγεται πάντοτε μεγαλύτερη ενέργεια από την υδρόλυση του ATP παρά από της φωσφοκρεατίνης
Σχηματίζεται ATP από τη φωσφοκρεατίνη μέσω εξεργονικής αντίδρασης
Υπάρχει στους γραμμωτούς μυς φωσφοκρεατίνη σε πολύ μεγαλύτερη ποσότητα σε σχέση με το ATP
Το συνένζυμο Α ανακαλύφθηκε το 1946 από τον Fritz Lipmann, ο οποίος αρχικά σκόπευε να μελετήσει την ακετυλομεταφορά στα ζώα. Κατά τη μελέτη του, εντόπισε ένα μοναδικό παράγοντα που δεν ήταν παρών σε ενζυμικά εκχυλίσματα, αλλά υπήρχε σε όλα τα όργανα των ζώων. Κατάφερε να απομονώσει από ήπαρ γουρουνιού και ανακάλυψε ότι η λειτουργία του σχετιζόταν με ένα συνένζυμο που είναι ενεργό στην ακετυλίωση της χολίνης. Έτσι, για την ανακάλυψη του συνενζύμου Α και της σημασίας του για τον ενδιάμεσο μεταβολισμό, ο Lipmann κέρδισε το 1953 βραβείο Nobel στη Φυσιολογία της Ιατρικής. Σχετικά με το συνένζυμο αυτό, τι δεν αληθεύει;
Το ακετυλο-CoA που σχηματίζει με το οξικό, σταθεροποιείται με συντονισμό στο ιοντισμένο καρβοξύλιο
Στο μόριό του περιέχει παντοθενικό
Διαθέτει μια δραστική ομάδα -SH
Στο μόριό του περιλαμβάνεται μια μονάδα β-μερκαπτοαιθυλαμίνης
Μεταξύ άλλων, στη δομή του εντοπίζεται μονάδα ATP
Οι θειοεστέρες:
Σταθεροποιούνται περισσότερο με συντονισμό σε σχέση με τους εστέρες οξυγόνου
Με υδρόλυση δίνουν αλκοόλες της μορφής R—OH
Έχουν μικρότερη κατ' απόλυτη τιμή ΔG υδρόλυσης σε σχέση με τις συντονισμένες μορφές των εστέρων οξυγόνου
Περιλαμβάνουν το ακετυλο-CoA
Είναι όλοι της μορφής CH₃—CO—S—R
Η ενδομετατροπή του ATP σε NTP δεν:
Διεκπαιρεώνεται με τη δράση της κινάσης των διφωσφορικών νουκλεοσιδίων
Επιτελείται με trans-φωσφορυλίωση
Περιλαμβάνει τη συμμετοχή καταλοίπων ιστιδίνης στα ένζυμα
Μεσολαβείται από ένζυμα που απαιτούν Mg²⁺
Μπορεί να αναφέρεται στην αντίδραση ATP + TTP → ADP + TDP + 2Pᵢ
Τι δεν ισχύει για το ενεργειακό φορτίο;
Αντανακλά το ποσοστό των φωσφοανυδριτικών δεσμών
Παίρνει τιμές από 0 μέχρι 1
Για τιμές πάνω από 0,78 επικρατεί η αναβολική πορεία του μεταβολισμού του ATP
Για τιμές κάτω από 0,78 τείνει να παράγεται ΑΤΡ
Ορίζεται ως το κλάσμα ([ATP]+½[ADP])/([ATP]+[ADP]+[AMP])
Δίνεται η αντίδραση σχηματισμού του αιθινίου: 2C(s) + H₂(g) → CH≡CH(g) και οι ακόλουθες θερμοχημικές αντιδράσεις: ① CH≡CH(g) + ⁵/₂O₂(g) → 2CO₂(g) + H₂O(ℓ) [ΔH° = −1299,5 kJ], ② C(s) + O₂(g) → CO₂(g) [ΔH° = −393,5 kJ] και ③ H₂(g) + ½O₂(g) → H₂O(ℓ) [ΔH° = −285,8 kJ]. Βάσει των τριών αυτών αντιδράσεων, η ΔH° της αντίδρασης σχηματισμού του αιθινίου είναι:
�1979,8 kJ
+1979,8 kJ
�226,7 kJ
+226,7 kJ
Άλλη απάντηση
Παράδειγμα αναγωγής είναι:
Η αύξηση του αριθμού οξείδωσης (Α.Ο.)
Η πρόσληψη ηλεκτρονίων
Η απώλεια υδρογόνου
Η πρόσληψη οξυγόνου
Η αντίδραση να περιλαμβάνει ηλεκτρόνια στα προϊόντα
Ο αριθμός οξείδωσης (Α.Ο.) δεν είναι μηδέν:
Σε μονοατομικά μόρια
Σε αμιγή μέταλλα
Σε ελεύθερα στοιχεία
Σε ένα πολυατομικό ιόν
Σε μια μοριακή ένωση
Ποιο από τα παρακάτω στοιχεία δεν έχει σταθερό αριθμό οξείδωσης;
Na
Mg
H
K
Ca
{"name":"(1): Βιοενεργητική, Θερμοδυναμική και Οξειδοαναγωγικές Αντιδράσεις - ΝΠρ", "url":"https://www.quiz-maker.com/QPREVIEW","txt":"Εάν η ΔG'° της αντίδρασης Α → Β είναι −40kJ\/mol, υπό κανονικές συνθήκες η αντίδραση:, Για την αντίδραση Α → Β, η ΔG'° είναι −60kJ\/mol. Η αντίδραση ξεκίνησε με 10mmol A και αρχικά δεν υπήρχε καθόλου Β. Μετά από 24 ώρες, εξακριβώθηκε η παρουσία 2mmol B και 8mmol A. Ποια είναι η πιθανότερη εξήγηση;, Όταν ένα μείγμα 3-φωσφογλυκερινικού και 2-φωσφογλυκερινικού επωάζεται στους 25°C με φωσφογλυκερινική μουτάση μέχρι να επιτευχθεί ισορροπία, το τελικό μείγμα περιέχει έξι φορές περισσότερο 2-φωσφογλυκερινικό από ό,τι 3-φωσφογλυκερινικό. Ποια από τις ακόλουθες δηλώσεις είναι ορθή, όσον αφορά στην αντίδραση που αναφέρεται; (R = 8,315 J\/mol•K, T = 298K)","img":"https://cdn.poll-maker.com/42-1409654/aa-t-.png?sz=1200-00000000000971609332"}
More Quizzes
Make a list of all negative suggestions you say to yourself
320
Mortred's Thief Quiz. It's a Secret, don't Worry ... I SAID DON'T WORRY!!!
20100
Induction'22
126151
Milyen bőrönd vagyok?
940
Human Growth & Development Practice Test - Challenge
201062326
Test Your Salesforce Admin Skills: CSA Certification
201031505
How Do You Spell Trivia? Take Our Spelling Now!
201031126
Common Elements: Test Your Element Knowledge Now
201024866
Which Marvel Character Are You? Discover Your Hero Boyfriend
201027025
Educational Psychology Field Instruction
15820749
Free Anti-Corruption Awareness
201021610
Test Your Math Skills: Free Fundamental Arithmetic
201033582