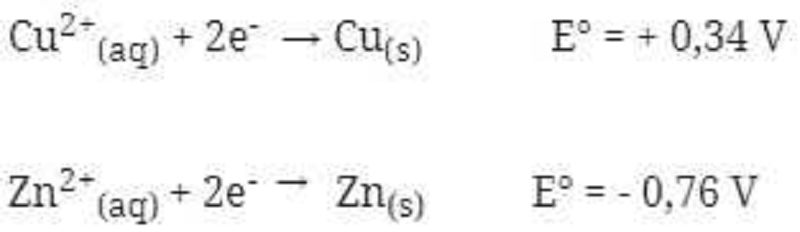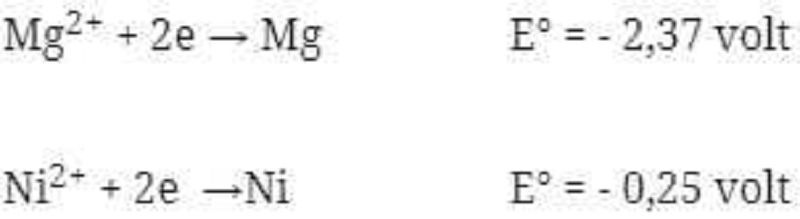SEL VOLTA
{"name":"SEL VOLTA", "url":"https://www.quiz-maker.com/QPREVIEW","txt":"Test your knowledge on electrochemical cells with our engaging quiz! Dive into the fascinating world of voltaic and electrolytic processes, understand the principles of oxidation and reduction, and explore the materials involved in electrochemical reactions.This quiz is perfect for students and enthusiasts of chemistry and electrochemistry.Multiple choice questionsCovers key concepts of electrochemistryFun and educational!","img":"https:/images/course2.png"}
More Quizzes
A. Pilihan Ganda
Pilihlah satu jawaban yang benar!
1580
Elektrolisis
10540
ALT Planner
7422
Animal Nutrition and Feed Technology DIV Quiz
10534
Rationality - Logical Reasoning with Answers (Free)
201020022
MLA Letter Format - Free Business Report Practice
201017675
Smith System 5 Keys - Free On‑Road Practice
201021268
Esthetician Practice Exam - Free State Board Prep
201017408
NQESH Meaning - Free School Heads Exam Practice
201019833
Sound Bouncing Back - Waves, Light & Refraction
201022476
CDL Combination Vehicles Practice - Free Online
201023011
What Type of Wizard Am I? Free to Reveal Your Type
201018026