ESERICITAZIONE LAB

Cromatografia e Tecniche di Separazione
Metti alla prova le tue conoscenze sulle tecniche di laboratorio con il nostro quiz dedicato alla cromatografia e alle metodologie di analisi delle proteine! Questo quiz è progettato per fornirti un'ottima opportunità di apprendimento e revisione, ideale per studenti e professionisti del settore scientifico.
- Rispondi a 30 domande su argomenti rilevanti
- Scopri le tue aree di forza e quelle da migliorare
- Perfetto per prepararsi a esami o per aggiornamenti professionali
Quale è l'utilizzo del blu destrano nella cromatografia di gel filtrazione?
Permette di calcolare il volume morto (Vo) della colonna
Permette di seguire la separazione delle particelle
Nessuna delle risposte proposte
Permette di calcolare il tempo della separazione cromatografica
Per evidenziare una proteina di interesse all'interno di una miscela complessa è più corretto:
Utilizzare una SDS-PAGE per individuare la banda di interesse sulla base del peso molecolare
svolgere un'elettroforeel nativa per individuare eventuali complessi sovramolecolari
Svolgere urielettroforesi in condizioni denaturanti e un western blot utilizzando un anticorpo specifico
Quantificare le proteine con un metodo colorimetrico
In una corsa cromatografica il volume morto:
E' il volume di fase mobile necessaria per il lavaggio della colonna successivamente all'uscita dei componenti di interesse
E il volume di ritenzione di un composto che è escluso dalla fase stazionaria
E' il volume che è possibile raccogliere tra due picchi successivi.
E' il volume di ritenzione di un composto che è completamente trattenuto nella fase stazionaria
Per determinare la concentrazione del seguente peptide KRRALIKCIICHDRKLIISGRKK quale metodo NON è possibile utilizzare ? Scegli un'alternativa:
Il metodo dell'acido bicinconinico (BCA)
Metodo diretto dell'assorbanza a 280 nm calcolando 20min basa alla sequenza
Il metodo di Bradford
Etodo diretto dell'assorbanza a 214 nm misurando anche l'assorbanza del legame peptidico
Mediante cromatografia di esclusione dimensionale vuoi separare una miscela contenente 3 proteine di MM 440000, 67000 e 17000. Scegli la resina con fintervallo di separazione adatto. Scegli un'alternativa:
2500-40000
3000-50000
10000-600000
70000-2000000
Quanti g di etanolo sono contenuti in un bicchiere di vino da 125 ml, se la sua gradazione alcolica è 13.0 % e la densità delletanolo = 0.789 g cm? Scegli un'alternativa:
12.8 g
20.5 g
5.61g
15.0 g
Una soluzione tampone si può preparare mescolando:
Un acido forte ed un sale contenente la base coniugata del tampone
Una base forte ed un elettrolita contenente l'acido coniugato del tampone
Un acido debole ed elettrolita contenente la rispettiva base coniugata
Tutte e tre le risposte
Il quenching di fluorescenza è un fenomeno di interferenza che:
Sposta la lunghezza d'onda della luce di fluorescenza emessa dal campione
Riduce intensità di fluorescenza del campione
Aumenta l'intensità di fluorescenza del campione
Avviene esclusivamente con campioni ad elevata concentrazione
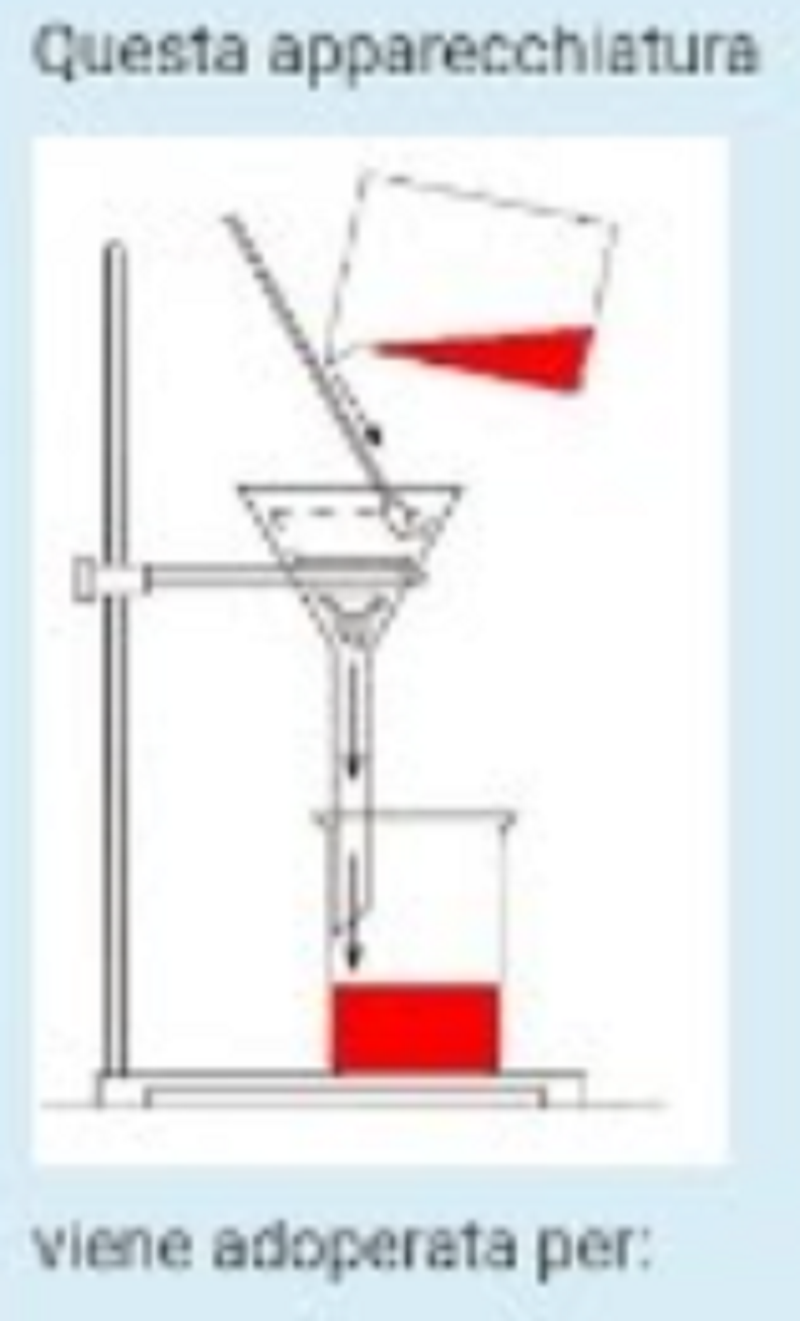
Questa apparecchiatura viene adoperata per:
Filtrare un solido da un liquida: si è interessati a recuperare il solido
Separare due solidi tra loro mescolati
Filtrare un solido da un liquida: si è interessati a recuperare il liquido
Separare una miscela eterogenea di liquidi
Il valore della costante di acidità Ka di un acido:
E' tanto più grande quanto più l'acido è forte
E' tanto più piccolo quanto più l'acido è forte
Nessuna delle altre risposte
E' sempre costante per tutti gli acidi
250 ml di HCI 0,6 M vengono prelevati ed aggiunti a 500 ml di acqua. Successivamente 1 ml di questa soluzione appena ottenuta viene ulteriormente diluito di 10 volte. La concentrazione finale della soluzione di HCI è Scegli un'alternativa
0,2 M
0,02M
0,03 M
0,3 M
Utilizzando la centrifugazione differenziale per la preparazione di frazioni subcellulari, è necessario considerare che:
Il tempo di centrifugazione è una variabile che non influisce sulla preparazione
La frazione ottenuta non potrà mai essere utilizzata per dosare alcuna attività enzimatica
Frazione ottenuta potrà avere buone rese, ma sarà contaminata da frazioni con coefficienti di sedimentazione simile
La densità della soluzione di omogenizzazione dovrà essere sempre maggiore a quella degli organelli da purificare
Per valutare il peso molecolare di una proteina purificata è possibile utilizzare
una elettroforesi nativa, se associata anche alla corsa di marker di peso molecolare
Una SDS-PAGE associando anche la corsa di una miscela di marker di peso molecolare
Un'elettroforesi nativa, abbinata alla corretta percentuale di acrilamide
Una SDS-PAGE associando una colorazione con blu di Comassie
0.30705 g di uno standard primario acido con mm = 307.05 g/mol vengono sciolti in qualche mL di acqua. 6.0 mL di una soluzione madre contenente KOH puro (mm = 56.11 g/mol) sono titolati dalla soluzione contenente lo standard. Successivamente a 10 mL della soluzione madre di KOH sono aggiunti 30 mL di acqua. Determinare rispettivamente: 1) il numero di moli dello standard primario acido; 2) la sua concentrazione in mol/L; 3) la concentrazione della soluzione madre di KOH in mol/L; 4) I grammi di KOH contenuti nel V necessario alla titolazione; 5) la concentrazione della soluzione di KOH dopo la diluizione con acqua in mol/L.
1) 1.000x10^-3 mol 2) impossibile da determinare 3) 0.17 mol/L 4) 0.056g 5) 0.028 mol/L
1) 1.000x10^-3 mol 2) 1.000x10^-3 mol/L 3) 0.17 mol/L 4) 0.056g 5) 0.056 mol/L
1) 1.000x10^-3 mol 2) impossibile da determinare 3) 0.17 mol/L 4) 0.056g 5) 0.042 mol/L
1) 1.000x10^-3 mol 2) 1.000x10^-3 mol/L 3) 0.17 mol/L 4) 0.030 g 5) 0.056 mol/L
Qual'è la molarità di una soluzione di H2SO4 (mm=98,079g/mol) con purezza 60% e densità 1,5 g/mol? Quanti mL di tale soluzione devono essere prelevati e diluiti per ottenere una soluzione di concentrazione 0.10M e volume 100mL?
9.18 M 1.1 mL
18.3 M 0.55 mL
10.3 M 0.58 mL
8.30 M 0.55 mL
Quale delle seguenti affermazioni relativa alle tecniche centrifugative è FALSA:
Utilizzando quella differenziale, si ollengono sempre due frazioni, un fondello e un surnatante
In alcune tipologie di centrifugazione possono essere utilizzate soluzioni con densità uguale alla frazione di interesse
è possibile utilizzare soluzioni in gradiente di concentrazione
Sono tutte tecniche indipendenti del tempo
Se per una cromatografia a scambio ionico utilizzo una resina scambiatrice di anioni, significa che:
La resina ha cariche positive
La resina ha cariche negative
Nessuna delle risposte
Posso separare una miscela di molecole con diversa carica positiva
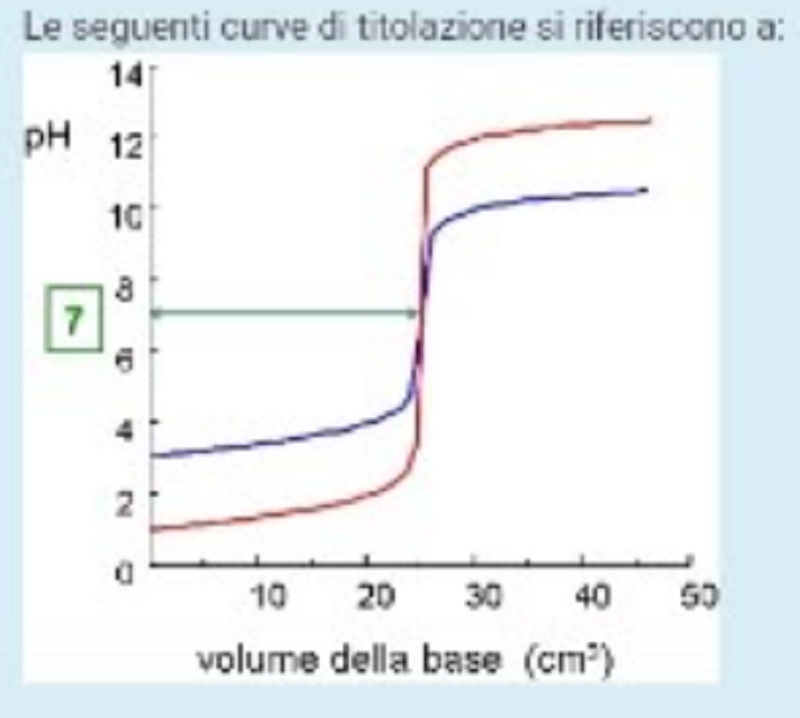
Le seguenti curve di titolazione si riferiscono a
Entrambe sono curve di titolazione di acido forte con base forte: la rossa rappresenta il caso di concentrazioni dei reattivi più elevata rispetto alla curva blu
La rossa: titolazione di acido debole con base forte. La blu: titolazione di acido forte con base forte.
La rossa titolazione di base debole con acido forte. La blu titolazione di base forle con acido forte.
La rossa titolazione di acido forte con base forte. La blu titolazione di acido debole con base forte
Si sta lavorando con due modelli cellulari, uno umano e uno murino, per studiare le condizioni sperimentali capaci di modulare l'espressione di una proteina di interesse presente in entrambi I modelli. Utilizzando la tecnica del western blot sarà opportuno
Acquistare degli anticorpi secondari specifici contro le regioni isotipie umana e murina
Utilizzare un unico anticorpo primario con reattività per la proteina di entrambe le specie
Utilizzare due anticorpi primari sviluppati in uomo e topo
Utilizzare un anticorpo primario specifico per epitopi conformazioni delle due specie
Nella cromatografia d'affinità, l'imidazolo viene utilizzato per eluire proteine:
Solamente se ricombinate con GFP (green fluorescent protein)
Solamente se è possibile seguire l'eluizione in fluorescenza
Solamente se queste presentano code poli-istidina
Solamente se la proteina ha istidine nella propria sequenza
In un grafico dei doppi reciproci, è possibile calcolare la Vmax di una reazione sapendo che:
Il punto di intersezione tra la retta delle letture e l'asse delle ascisse corrisponde a 1/Vmax.
Il punto di intersezione tra la retta delle letture e l'asse delle ordinate corrisponde a 1/Vmax.
Il punto di intersezione tra la retta delle letture e l'asse delle ordinate corrisponde a 1/Vmax.
Il punto di intersezione tra la retta delle letture e l'asse delle ascisse corrisponde a -1/Vmax.
Nelle tecniche immunochimiche, la scelta di utilizzare o meno un anticorpo secondario dipende:
Dalla specie in cui è stato prodotto anticorpo primario
Dal tempo a disposizione
Dalla necessità di amplificare il segnale
Dalla localizzazione della proteina di interesse
Secondo la legge di Lambert-Beer, noti assorbanza e coefficiente di estinzione molare di un composto, nonché cammino ottico della cuvette, la concentrazione può essere calcolata come:
C=A/e
C=Ael
C=A/el
C=(1/A)el
Per soluzioni diluite, l'intensità di fluorescenza di un fluoroforo irradiato con una radiazione elettromagnetica di una certa lunghezza d'onda, è direttamente proporzionale a:
Alla lunghezza d'onda di irraggiamento
Solo alla resa quantica della molecola
All'assorbimento della molecola e alla resa quantica della molecola
Solo all'assorbimento della molecola
Per la rilevazione di antigeni di Legionella pneumophila nelle urine di un paziente si utilizza un test ELISA a sandwich. Tale test
Utilizza un anticorpo primario adesso al pozzetto, capace di immobilizzare l'antigene presente nel campione e un secondo anticorpo primario coniugato capace di riconoscere e legare un altro epitomo dell'antigene per la sua rilevazione (metodo diretto)
Prevede l'adesione dell'antigene (se presente) sul fondo del pozzetto e la sua rilevazione tramite l'utilizzo di un anticorpo primario specifico e di un anticorpo secondario coniugato
Prevede l'adesione dell'anticorpo primario al fondo del pozzetto e la rilevazione dell'avvenuta formazione del complesso antigene anticorpo, utilizzando un anticorpo secondario coniugato
Non è il metodo più opportuno di rilevazione perchè non è specifico
Nella preparazione di un gel di acrilammide talvolta accade che non vi sia polimerizzazione. Cosa può essere successo?
Non si è portata la temperatura al disotto dei 40C
Nella preparazione della miscela non è stato aggiunto tampone
è stato utilizzato un tampone con il pH sbagliato
Nella preparazione della miscela non sono stati aggiunti TEMED o persolfato
Quanti g di KNO3 (pm 101.10 g/mol) si devono pesare e mettere in un matraccio tarato con V = 100.0 mL per ottenere una soluzione madre 0.2000 M? E se si mettono 50.00 mL di tale soluzione madre in un secondo matraccio tarato con V = 100.0 mL e si aggiunge acqua fino alla tacca, qual è la concentrazione della nuova soluzione ottenuta?
10.11 g conc soluz 2 = 0.2000 M
2.022 g conc soluz 2 = 0.1000 M
1.011 g conc soluz 2 = 0.1000 M
3.033 g, conc soluz 2 = 0.0500 M
In una cinetica enzimatica, la Km può essere considerata per avere una prima stima
Della costante molecolare dell'enzima
Dell'affinità dell'enzima per il suo substrato
Della temperatura di denaturazione dell'enzima espressa in gradi celsius
Della velocità massima raggiungibile dalla reazione
Per effettuare delle misure di assorbimento nella regione del UV posso usare cuvette di quale materiale?
Cuvette di qualunque plastica, perchè hanno pari trasparenza al quarzo ma sono più economiche e infrangibili
Solo cuvette di quarzo perchè a differenza di altri materiali sono le uniche trasparenti all'UV
Cuvette di quarzo, oppure se si lavora sotto I 250nm posso usare cuvette in plastica speciale
Cuvette di quarzo, oppure se si lavora sopra I 250nm posso usare cuvette in plastica speciale
Un dato composto ha il picco massimo di assorbanza a 310 nm. Suo spostamento di Stokes è di circa 70 nm. Scegliere il miglior compromesso tra I filtri che avete a disposizione per effettuare delle misure di fluorescenza sul composto in esame.
Eccitazione: 240 nm Emissione: 310 nm
Eccitazione: 300 nm Emissione: 395 nm ✓
Eccitazione: 310 Emissione: 245 nm
Eccitazione: 310 Emissione: 485 nm
A uno studente è chiesto di preparare 150 mL di una soluzione tampone HNO₂/KNO₂ a pH 3,75. Sullo scaffale trova una soluzione 0,400 M di HNO₂ e una soluzione 0,650 M di KNO₂. Quanti mL di ciascuna soluzione deve aggiungere per preparare la sua soluzione? (Ka di HNO₂ = 4,5 × 10^)
72,5 mL di KNO₂ e 77,5 mL di HNO₂
35,4 mL di KNO₂ e 114,6 mL di HNO₂
91,3 mL di KNO₂ e 58,7 mL di HNO₂
85,6 mL di KNO₂ e 64,4 mL di HNO₂
Un indicatore acido/base con pKa = 6.0 assume colore rosso nella forma indissociata Hin e colore blu nella forma disociata in-. Che colore ha l'indicatore rispettivamente a pH = 3, 4 e 8? In quale intervallo di pH vira?
A pH 3 rosso, a pH 4 rosso, a pH 8 blu. Gli indicatori virano ad un valore di pH preciso e non in un intervallo. In questo caso l'indicatore vira a pH 6, cioè al valore di pH = al suo pka.
A pH 3 blu, a pH 4 blu, a pH 8 rosso. Vira nell'intervallo di pH tra 5 e 7
A tutti I pH considerati è rosso perché in queste condizioni di pH l'indicatore non vira
A pH 3 rosso, a pH 4 rosso, a pH 8 blu. Vira nell'intervallo di pH tra 5 e 7
Quale tra questi amminoacidi può essere quantificato con misure di assorbanza a 280 nm ?
La tirosina
La cisteina
L'arginina
La serina
In quale delle seguenti condizioni un microorganismo corre il rischio maggiore che I propri enzimi vengano denaturati:
Un aumento considerevole della temperatura del suo habitat
Una mancanza di substrati, che provoca l'autocatalisi denaturante degli enzimi.
Una riduzione considerevole della temperatura del suo habitat.
Un eccesso di substrati enzimatici, che esaurisce gli enzimi convertendoli in prodotti.
In una reazione catalizzata enzimaticamente:
L'enzima mantiene invariata nel tempo la soglia energetica da superare per far avvenire la reazione, permettendole di procedere a velocità costante.
L'enzima facilita la reazione finchè esso non viene consumato dai reagenti
L'enzima innalza la soglia energetica da superare per far avvenire la reazione
L'enzima abbassa la soglia energetica da superare per far avvenire la reazione.
Un anticorpo viene utilizzato principalmente per:
Il suo ridotto costo
La sua stabilità nel tempo
la sua specificità
Il suo elevato peso molecolare
Nella separazione elettroforetica delle proteine all'interno dello stacking, il pH di 6.8 è fondamentale per:
per rendere neutre le proteine prima che entrino nel running gel
Compattare le proteine tra glicina e cloruro
Per aumentare la quantità di SDS legato alle proteine
Avere tutte le proteine cariche positivamente
In un gel di poliacrilamide un tampone a pH 8,8 viene di solito utilizzato:
Per impaccare I campioni nella prima parte della corsa elettroforetica
Per visualizzare il fronte di corsa
per mantenere la glicina in forma carica
Per impaccare I campioni
Il sodio dodecil solfato (SDS):
garantisce una uniforme carica negativa alle proteine
Si lega ai domini carichi delle proteine
garantisce una uniforme carica positiva alle proteine
Garantisce la rottura dei ponti disolfuro tra le proteine
In un gel di poliacrilammide al 15% verranno separate adeguatamente 2 proteine del PM di:
150-200 KDa
20 e 30 KDa
50-70 KDa
100-120 KDa
In un rotore ad angolo fisso:
Le particelle subiscono forza centrifuga crescente con l’aumentare della distanza dall’asse di rotazione
La velocità di rotazione è limitata nel tempo
La distanza dall’asse di rotazione è costante
L’accelerazione delle particelle è costante
In cosa differiscono il surnatante e il pellet?
Le particelle nel pellet sono più dense delle particelle nel surnatante
Solo il surnatante può essere ulteriormente analizzato
Solo il pellet può essere ulteriormente analizzato
Le particelle nel supernatante sono più dense delle particelle nel pellet
Perché è importante bilanciare I campioni nella centrifuga?
Campioni non bilanciati possono causare malfunzionamenti della refrigerazione.
Campioni sbilanciati possono causare la propulsione della centrifuga dal luogo di riposo
È difficile chiudere il coperchio su una centrifuga con campioni non bilanciati
Le centrifughe con campioni non bilanciati possono avere letture di RPM errate.
Un liquore ha una gradazione alcolica di 28.0 gradi. Sapendo che la densità dell'EtOH è 0.789 g/cm3, quanti mL e quanti g di alcol sono contenuti in un bicchierino da 20.0 mL di liquore?
5.60 mL pari a 4.42 g
28.0 mL pari a 22.09 g
4.42 mL pari a 5.60 g
22.09 mL pari a 28.0 g
Tra quelli qui descritti, qual è il metodo corretto per preparare una soluzione di CuSO4 (mm = 158.88 g/mol) con concentrazione 0.0100 M e con V = 100.0 mL, avendo a disposizione una bilancia analitica con sensibilità 0.0001 g?
. Si mette sul piatto della bilancia analitica un recipiente pulito e asciutto, ad es. Un vetrino d’orologio, si preme il pulsante di sottrazione automatica della tara e successivamente si pesano 0.1589 g del solido CuSO4. Si trasferisce il solido quantitativamente in un matraccio tarato da 100.0 mL (pulito e necessariamente asciutto) adoperando un imbuto e una spruzzetta contenente acqua. Dopo aver riempito il matraccio per circa 3/4 del suo volume e averlo tappato, lo si agita vigorosamente fino a dissoluzione del precipitato. Alternativamente si può mettere il matraccio su un agitatore magnetico dopo avervi introdotto un’ancoretta magnetica. Quando il soluto è tutto sciolto, si porta a volume fino alla tacca di riferimento usando una spruzzetta e/o una pipetta di Pasteur. Nel caso in cui si sia introdotta una ancoretta magnetica, questa va tolta adoperando un magnete che va tenuto all’esterno del recipiente per non inquinare la soluzione e solo successivamente si aggiunge acqua per portare a volume. Nel caso in cui aggiungendo l’acqua si superi la tacca di riferimento, è sufficiente togliere l’eccesso con una pipetta di Pasteur fino a quando il livello della soluzione raggiunge la tacca.
Si mette sul piatto della bilancia analitica un recipiente pulito e asciutto, ad es. Un vetrino d’orologio, si preme il pulsante di sottrazione automatica della tara e successivamente si pesano 0.1589 g del solido CuSO4. Si trasferisce il solido quantitativamente in un matraccio tarato da 100.0 mL (pulito, ma non necessariamente asciutto) adoperando un imbuto e una spruzzetta contenente acqua. Dopo aver riempito il matraccio per circa 3/4 del suo volume e averlo tappato, lo si agita vigorosamente fino a dissoluzione del precipitato. Alternativamente si può mettere il matraccio su un agitatore magnetico dopo avervi introdotto un’ancoretta magnetica. Quando il soluto è tutto sciolto, si porta a volume fino alla tacca di riferimento usando una spruzzetta e/o una pipetta di Pasteur. Nel caso in cui si sia introdotta una ancoretta magnetica, questa va tolta adoperando un magnete che va tenuto all’esterno del recipiente per non inquinare la soluzione e solo successivamente si aggiunge acqua per portare a volume.Nel caso in cui aggiungendo l’acqua si superi la tacca di riferimento, è necessario buttare via la soluzione, lavare bene il recipiente per non lasciare tracce e rifare tutta la procedura.
Si mette sul piatto della bilancia analitica un recipiente pulito e asciutto, ad es. Un vetrino d’orologio, si preme il pulsante di sottrazione automatica della tara e successivamente si pesano 0.1589 g del solido CuSO4. Si trasferisce il solido quantitativamente in un becher da 100.0 mL (pulito e rigorosamente asciutto) adoperando un imbuto e una spruzzetta contenente acqua. Dopo aver riempito il becher per circa 3/4 del suo volume e averlo tappato, lo si agita vigorosamente fino a dissoluzione del precipitato. Alternativamente si può mettere il becher su un agitatore magnetico dopo avervi introdotto un’ancoretta magnetica. Quando il soluto è tutto sciolto, si porta a volume fino alla tacca di riferimento usando una spruzzetta e/o una pipetta di Pasteur. Nel caso in cui si sia introdotta una ancoretta magnetica, questa va tolta adoperando un magnete che va tenuto all’esterno del recipiente per non inquinare la soluzione e solo successivamente si aggiunge acqua per portare a volume. Nel caso in cui aggiungendo l’acqua si superi la tacca di riferimento, è necessario buttare via la soluzione, lavare bene il recipiente per non lasciare tracce e rifare tutta la procedura.
Si mette sul piatto della bilancia analitica un recipiente pulito e asciutto, ad es. Un vetrino d’orologio, si preme il pulsante di sottrazione automatica della tara e successivamente si pesano 0.1589 g del solido CuSO4. Si trasferisce il solido quantitativamente in un becher (pulito, ma non necessariamente asciutto) adoperando un imbuto e una spruzzetta contenente acqua. Adoperando una buretta si aggiungono esattamente 100.0 mL di acqua e si agita vigorosamente la soluzione con una bacchetta in vetro fino a dissoluzione del precipitato. Alternativamente si può mettere il becher su un agitatore magnetico dopo avervi introdotto un’ancoretta magnetica.
Il filtro o imbuto di Buchner serve per
separare un liquido da un solido e si adopera quando si è interessati a tenere il solido
Separare tra loro due soluzioni
separare tra loro due solidi
separare un liquido da un solido e si adopera quando si è interessati a tenere il liquido
L’acidità dell’aceto è dovuta dalla presenza di CH3COOH (me = 60.00 g/eq). Determinare la % di acidità di un aceto se 1.0 mL di esso sono titolati da 11.0 mL di una soluzione di NaOH 0.090 M. Densità dell’aceto = 1.0 g/mL.
5.4 %
5.9 %
4.9 %
4.3 %

Tabella delle solubilità di A e di I in g di soluto / L di H2O a 5 e a 95 °C:
Da una sintesi si ottengono 0.50 g di un composto A assieme a 0.04 g di impurezze I. Usando la tabella di solubilità a 5 e 95 °C sopra riportata, calcolare:
1) I mL di H2O necessari a sciogliere completamente A a 95 °C
2) I g di A che restano sciolti dopo che la soluzione 1) viene raffreddata a 5 °C
3) dire se le impurezze restano tutte in soluzione o precipitano parzialmente a 5 °C.
1) 44 mL, 2) 0.266 g 3) restano tutte in soluzione
1) 10 mL, 2) 0.133 g 3) restano tutte in soluzione
1) 33 mL, 2) 0.133 g 3) precipitano parzialmente
1) 66 mL , 2) 0.399 g 3) precipitano parzialmente
Da che cosa dipende la capacità tamponante di una soluzione tampone?
Dal rapporto delle concentrazioni dei componenti
Dalla concentrazione assoluta dei componenti HA e A- (oppure B e HB+)
Dal valore del pKa
dalla concentrazione assoluta dei componenti HA e A- (oppure B e HB+) e dal rapporto delle concentrazioni dei componenti
Qual è il pH di un tampone ottenuto mescolando 12.43 g di tris (base debole con pK = 8.075 e MM = 121.136) con 4.67 g del suo acido coniugato tris idrocloruro (MM = 157.597) con V = 1.00 L?
8,61
8,32
5,45
3,78
Quando la capacità tamponante di una soluzione tampone è massima?
pH = pKa
Sempre
pH=pKa ± 0,5
pH=pKa ± 1
Il tempo di ritenzione di una sostanza dipende da:
Cs, la concentrazione della sostanza nella fase stazionaria
Cm, la concentrazione della sostanza nella fase mobile
Kd, il coefficiente di distribuzione
Nessuna delle tre risposte
Quale fra le risposte proposte è FALSA? La cromatografia di esclusione dimensionale può essere utilizzata per:
Determinazione della massa molecolare
Nessuna delle tre risposte è corretta
Dissalazione
Purificazione di molecole biologiche
Mediante cromatografia di esclusione dimensionale vuoi separare una miscela contenente 3 proteine di MM 440000, 67000 e 17000. Hai a disposizione 4 resine che differiscono tra loro per l’intervallo di separazione. Quale NON puoi utilizzare?
3000 – 700000 Da
5000 – 1000000 Da
10000 – 600000 Da
80000 – 1000000 Da
Che tipo di gruppi chimici presenta una resina di cromatografia a scambio anionico?
gruppi carichi negativamente
Nessuna delle tre risposte
. Gruppi idrofobici
Gruppi carichi positivamente
Nel western blot, l'utilizzo dell'anticorpo secondario è:
Necessario solamente se l'anticorpo primario non è coniugato con un sistema di rilevamento sensibile
Necessario solamente se si vuole rendere specifico il riconoscimento dell'antigene
Necessario per evidenziare il complesso Antigene-Anticorpo 1°
Necessario per il riconoscimento specie-specifico dell'antigene
Nel trasferimento di proteine da gel a membrana, quest'ultima:
Deve essere prima imbevuta nel rosso ponceau per rendere evidenti le proteine una volta trasferite
Deve essere prima saturata per impedire il trasferimento aspecifico di proteine
Deve trovarsi più vicino al catodo rispetto al gel
Deve trovarsi più vicino all'anodo rispetto al gel
La tecnica dell'ELISA può essere utilizzata:
Come tecnica quantitativa per determinare la quantità di una molecola di interesse a patto che si usi una curva di taratura
Tutte le altre risposte
Come tecnica qualitativa per ricercare in un campione la presenza di una molecola di interesse
Sia come tecnica diretta che come tecnica indiretta
Utilizzando l'SDS-PAGE per la separazione di proteine con un pI >9, vi aspettate che le proteine
Possano migrare meno dell'atteso a causa della parziale neutralizzazione delle cariche negative dell'SDS con quelle positive delle proteine
Non migrino
Migrino più velocemente ma verso il catodo
Si separino come atteso secondo massa crescente
Da una cromatografia ad esclusione molecolare si raccoglie un picco con una massa molecolare di circa 150 kDa. Si decide di utilizzare una parte del picco per due corse elettroforetiche: una SDS_PAGE e una nativa. Nella prima corsa si ottengono 3 bande rispettivamente a 150, 50 e 25 kDa. Nella seconda separazione invece una sola banda a 150 kDa. Tale risultato suggerisce che:
L'SDS-PAGE ha parzialmente degradato il campione
la separazione cromatografica è stata inefficiente, infatti proteine con peso molecolare molto diverso sono state raccolte in un unico picco
La percentuale di acrilammide utilizzata non è quella ottimale
La banda cromatografica è costituita da due tipologie di proteine: 1 monomero ad alta massa molecolare (150 kDa) e da una proteina multimerica che nelle condizioni denaturanti dell'SDS-Page si è separata nelle subunità costituenti di 50 e 25 kDa.
Per valutare la contaminazione mitocondriale all'interno della frazione nucleare è opportuno:
Aumentare il grado di purificazione con una cromatografia ad esclusione molecolare
Valutare la presenza di un marcatore mitocondriale
Utilizzare metodi di purificazione diversi
Valutare all'interno del proprio campione, la presenza di un marcatore nucleare
La centrifugazione in gradiente:
è opportuno attuarla con rotori ad angolo fisso
è una tecnica indipendente dal tempo
Permette di separare anche organuli con densità simile
Uò essere attuata solamente con soluzioni di densit� > a quella delle particelle da separare
Il tempo di sedimentazione di una particella è:
Indipendente dalla sua dimensione
Indipendente dalla densità del mezzo
indipendente dalla forma della particella
Nessuna delle altre risposte
Una proteina a di coefficiente molare a 280 nm pari a 0,5 x 103 M-1 cm -1 presenta una assorbanza pari a A280nm= 0,5 . Trova la sua concentrazione sapendo che il cammino ottico della cuvette è 1 cm:
0,5 x 103 M
0,5 mM
1 mM
1 M
Nel metodo di dosaggio proteico mediante BCA (acido bicinconinico)
la concentrazione proteica si ricava da un composto che si misura a 360 nm
Il colore si sviluppa per reazione con I gruppi aromatici degli amminoacidi
La concentrazione proteica è proporzionale alla quantità di complesso BCA_Cu+ che si forma
Tutte le risposte sono sbagliate
Da che cosa dipende il fenomeno dello scattering della luce ?
solo dalla concentrazione delle particelle
Soltanto dalla lunghezza d'onda della luce irradiante
da tutte e tre le grandezze descritte nelle altre risposte
Soltanto dalla grandezza delle particelle e dalla loro forma
La lunghezza d'onda della radiazione emessa da un campione fluorescente rispetto alla lunghezza d'onda della luce utilizzata per irradiare il campione è:
sempre inferiore
Superiore, inferiore o uguale a seconda dell'energia della luce
Uguale in molti casi
sempre superiore
In presenza di un aumento di temperatura, in una cinetica enzimatica generalmente osserviamo:
Nessun effetto. La temperatura non influenza la cinetica enzimatica.
Una riduzione di velocità a meno che la temperatura non superi quella di denaturazione dell'enzima
Un aumento della velocità purchè la temperatura resti sotto quella di denaturazione dell'enzima.
Un aumento della velocità una volta superata la soglia di temperatura di denaturazione dell'enzima.
Scegliere fra le seguenti coppie coniugate la migliore per preparare una soluzione tampone a pH = 4,7
CH3COOH/CH3COOK Ka = 1,8 x 10^-5
HClO2/KClO2 Ka = 1,1 x 10^-2
HClO/KClO Ka = 2,9 x 10^-8
NH3/NH4Cl Kb = 1,76 x 10^-5
Per preparare una soluzione tampone a pH = 7.60 hai a disposizione Na2HPO4 •12H2O (mm = 359.14) e KH2PO4 (mm = 136.10 g/mol). Quanti g rispettivamente di A- e di HA devono essere pesati perché il tampone abbia V = 200 mL e concentrazione 0.10 M? pK per la dissociazione di HA = 7.20
G A- = 1,199; g HA = 10,223
G A- = 5,136; g HA = 0.776
g A- = 6,188; g HA = 0.029
G A- = 10,243; g HA = 2,589
Un litro di soluzione tampone contiene 0,1 moli di CH3COOH e 0,1 moli di CH3COONa (Ka = 1,8 x 10-5). Calcolare il pH della soluzione tampone dopo l’aggiunta di 10 mmoli di NaOH.
4,83
10,21
4,67
2,45
Nella cromatografia a esclusione di volume, quali composti eluiscono per ultimi dalla colonna?
Molecole di massa molecolare elevata
Cationi
Anioni
Molecole di massa molecolare piccola
Scegli la risposta sbagliata. Le tecniche cromatografiche si possono classificare in base a
Forma del supporto cromatografico
Stato fisico della fase mobile
Meccanismo di separazione
Temperatura e pressione di esercizio
La fase stazionaria è un liquido che impregna un solido granulare inerte o è ad esso chimicamente legato e in questo liquido le molecole da separare sono solubili. Durante l’eluizione le molecole si ripartiscono dinamicamente tra le due fasi secondo la diversa solubilità di ognuna. Questo tipo di cromatografia può essere gas-liquido o liquido-liquido a seconda della natura della fase mobile. Di che tipo di cromatografia si tratta?
Scambio Ionico
Esclusione molecolare
Ripartizione
Adsorbimento
Il seguente requisito: “conoscere la struttura e le proprietà di legame della molecola che si vuole isolare, per utilizzare il giusto ligando e scegliere (o sintetizzare) una buona resina” a che tipo di cromatografia si riferisce?
Affinità
Ripartizione
Esclusione di volume
Scambio Ionico
Il termine Ni-NTA (Nickel NTA) si riferisce a uno ione nichel 2+ che è stato accoppiato all'acido nitrilotriacetico (NTA). Ni-NTA viene legato solitamente ad una resina di agarosio. Per la purificazione di quale tipo di molecole viene usata questa resina?
Globine
Proteine His-tagged
Anticorpi
Polisaccaridi
Meno passaggi si effettuano e meno errori si commettono: pertanto se si deve pesare un certo composto da mettere in un pallone da reazione, conviene pesarlo direttamente nel pallone per evitare di spandere e perdere reattivo nei trasferimenti. Come si deve procedere?
Si pone sul piatto della bilancia la ciambella di sostegno e l'imbuto. Si azzera la tara. Si mette il pallone e si effettua la pesata
Si pone nel pallone il prodotto da pesare, successivamente si pone sul piatto della bilancia la ciambella di sostegno e il pallone. Si azzera la tara. Si infila nel pallone l'imbuto.
Si pone sul piatto della bilancia la ciambella di sostegno, il pallone e l'imbuto. Solo adesso si azzera la tara. Si effettua la pesata.
Si pone sul piatto della bilancia la ciambella di sostegno e il pallone. Si azzera la tara. Si infila nel pallone l'imbuto e si effettua la pesata.
Qual è la molarità di una soluzione di H2SO4 (mm = 98.079 g/mol) con purezza 90.0% e densità = 1.70 g/mL? Quanti mL di tale soluzione devono essere prelevati e diluiti per ottenere una soluzione di concentrazione 0.10 M e volume 100.0 mL?
10.3 M 0.58 mL
. 8.30 M 0.55 mL
18.3 M 0.75 mL
M 15.6 0.64 mL
0.2345 g di bicarbonato di sodio vengono messi in un matraccio tarato da 250.0 mL che viene portato a volume con acqua. Successivamente, dopo accurato mescolamento, 10.0 mL di questa soluzione vengono posti in un matraccio tarato da 100.0 mL che viene portato a volume con acqua. Qual è la concentrazione della soluzione finale ottenuta? Pm del bicarbonato di sodio NaHCO3 = 84.01 g/mol
1.12 x 10^-4 M
1.12 x 10^-2 M
1.12 x 10^-3 M
1.12 x 10^-1 M
Quando si usa un filtro di carta a pieghe? E' più o meno efficiente di uno di carta conico?
Si usa il filtro di carta a pieghe quando si vuole separare un liquido da un solido e si è interessati a tenere il solido. Nel filtro conico viene usata tutta la sua superficie per filtrare mentre nel filtro a pieghe ne viene usata solo 1/4. Dunque la filtrazione col filtro conico è molto più veloce ed efficiente di quella ottenuta su filtro a pieghe.
Si usa il filtro di carta a pieghe quando si vuole separare un liquido da un solido e si è interessati a tenere il liquido. Nel filtro a pieghe viene usata tutta la sua superficie per filtrare mentre nel filtro conico ne viene usata solo 1/4. Dunque la filtrazione col filtro a pieghe è molto più veloce ed efficiente di quella ottenuta su filtro conico.
Si usa il filtro di carta a pieghe quando si vuole separare un liquido da un solido e si è interessati a tenere il liquido. Nel filtro conico viene usata tutta la sua superficie per filtrare mentre nel filtro a pieghe ne viene usata solo 1/4. Dunque la filtrazione col filtro a pieghe è molto più lenta di quella ottenuta su filtro conico che quindi è più efficiente.
Si usa il filtro di carta a pieghe quando si vuole separare un liquido da un solido e si è interessati a tenere il solido. Nel filtro a pieghe viene usata tutta la sua superficie per filtrare mentre nel filtro conico ne viene usata solo 1/4. Dunque la filtrazione col filtro a pieghe è molto più veloce ed efficiente di quella ottenuta su filtro conico.
0.4800 g di NaOH umido (mm NaOH = 40.00 g/mol) sono messi in un matraccio tarato con volume 100.0 mL nel quale viene aggiunta H2O fino alla tacca di riferimento. 9.0 mL di tale soluzione sono titolati esattamente da 0.2119 g dello standard primario ftalato acido di potassio (mm = 204.233 g/mol) Determinare la M teorica, quella ottenuta per titolazione e la % di purezza in peso del NaOH. Se 1.0 mL di un aceto sono titolati da 8.7 mL della soluzione di idrossido, determinare la % di acidità dell’aceto.
M teorica 0.1200 M reale 0.120 purezza 100% acidità aceto 6%
M teorica 0.1200 M reale 0.115 purezza 96% acidità aceto 6%
M teorica 0.1200 M reale 0.115 purezza 96% acidità aceto 3%
M teorica 1.200 M reale 1.15 purezza 86% acidità aceto 6%
Nell'esperienza di titolazione acido-base è stata adoperata una soluzione di NaOH come standard secondario?
Gli standard primari e secondari si possono usare in alternativa perché hanno le stesse proprietà. NaOH, è uno standard primario e non secondario nonostante sia igroscopico.
No, si è usata la soluzione di NaOH come standard primario per titolare lo ftalato acido di potassio. Successivamente la soluzione di ftalato è stata usata per titolare degli acidi.
NaOH non è igroscopico pertanto si può usare come standard primario e non secondario.
Sì, infatti la soluzione di NaOH è stata titolata con ftalato acido di potassio che è uno standard primario. Una volta che si conosce la concentrazione della soluzione di NaOH questa può essere adoperata come standard secondario per titolare soluzioni di acidi.
Cosa fare in caso di un incendio di modeste proporzioni di un'apparecchiatura elettrica.
Prima di tutto spegnere l'interruttore della corrente dal quadro generale e poi buttare abbondante acqua sull'apparecchiatura.
Mettere l'apparecchiatura sotto la cappa e poi spegnere l'incendio con una coperta spegnifiamma o un estintore.
Coprire lo strumento con una coperta spegnifiamma e/o usare un estintore a polvere o a CO2 e solo dopo disinserire la spina dello strumento dalla presa di corrente.
Prima di tutto spegnere l'interruttore della corrente dal quadro generale e poi coprire lo strumento con una coperta spegnifiamma e/o usare un estintore a polvere o a CO2.
Se la molecola a presenta un coefficiente di estinzione molare superiore a b, a parità di concentrazione e cammino ottico, la molecola a presenterà un valore di assorbanza:
Che dipende dalla natura chimica di a e b
Superiore a b
Uguale a b
Inferiore a b
Quali di questi amminoacidi può essere caratterizzato con misure di assorbanza a 280nm?
Serina
Cisteina
Arginina
Tirosina
Di fronte ad un campione che emette luce, come si può distinguere se si tratta di bioluminescenza o di fluorescenza?
Se l'emissione avviene senza che il campione sia irradiato si tratta di fluroescenza
Se l'emissione avviene senza campione venga irradiato si tratta di bioluminescenza
Se l'emissione cade nello spettro del visibile si tratta di bioluminescenza
Se l'emissione è verde si tratta di fosforescenza
Quali tra le seguenti tecniche centrifugative è una tecnica di equilibrio
Centrifugazione differenziale
Centrifugazione zonale
Centrifugazione isopicnica
Nessuna delle risposte
In un rotore ad angolo fisso:
L'accelerazione delle partecelle è costante
La distanza dall'asse di rotazione è costante
Le particelle subiscono forza centrifuga crescente con l'aumentare della distanza dall'asse di rotazione
La velocità di rotazione è limitata nel tempo
Come anticorpo primario si intende
Un anticorpo usato in western blot contemporaneamente a quello secondario marcato
Un anticorpo usato in numerose tecniche di immunochimiche indirette in associazione con un anticorpo secondario marcato
Un qualsiasi anticorpo ottenuto tramite purificazione
Un anticorpo usato in numerose tecniche immunochimiche specifiche per l'emoglobina
Quanti mL di una soluzione di NaOH 0,5 M devono essere aggiunti a 10g di un acido debole con pKa = 8,075 e MM pari a 157,597 per ottenere 250mL di soluzione tampone a pH 7,6?
45,7
5,1
10,5
31,8
La separazione mediante cromatografia per affinità si basa su:
La carica elettrica dell'analita
La massa molecolare dell'analita
Interazione specifica dell'analita con un ligando
Il tempo di ritenzione dell'analita
L'acidità dell'aceto è dovuta all'acido acetico (mm = 60g/mol). Determinare la % di acido acetico se 1mL di esso sono titolati da 9,5mL di una soluzione di NaOH 0,09 M. Densità aceto = 1g/mL
5,1%
6,1%
7,0%
4,5%
Gli standard secondari garantiscono la stessa precisione e accuratezza di quelli primari nelle titolazioni?
Si, anzi, spesso quelli secondari sono più affidabili di quelli primari
Gli standard secondari sono per definizione più stabili e quindi preferibili a quelli primari
No, proprio perchè gli standard secondari vanno a loro volta preventivamente titolati da uno standard primario. Questa operazione in più indica comunque un errore supplementare.
Si, si possono adoperare in alternativa con le stesse garanzie di precisione e accuratezza nelle titolazioni
{"name":"ESERICITAZIONE LAB", "url":"https://www.quiz-maker.com/QPREVIEW","txt":"Metti alla prova le tue conoscenze sulle tecniche di laboratorio con il nostro quiz dedicato alla cromatografia e alle metodologie di analisi delle proteine! Questo quiz è progettato per fornirti un'ottima opportunità di apprendimento e revisione, ideale per studenti e professionisti del settore scientifico.Rispondi a 30 domande su argomenti rilevantiScopri le tue aree di forza e quelle da migliorarePerfetto per prepararsi a esami o per aggiornamenti professionali","img":"https:/images/course8.png"}
More Quizzes
FISIOLOGIA 1
101500
MALATTIE INFETTIVE
15817
Textile and Composite Materials Quiz
2312195
Discover Your Inner Goddess
158619
AT&T Wireless Knowledge Check Answers - Free
201017408
Alexa Song - Which Early 2000s Hit Will You Get?
201018630
C1 English Vocabulary Test - Gap-Fill (Free)
201018322
IRead Practice Test 2nd Grade (Free Online)
201015963
Macros in Food - Carbs, Protein, and Fat Test
201018790
Kindergarten Counting by 10s - Free Practice
201015963
Kolb Learning Style Inventory Test - Free Online
201018397
CWI Practice Test - Free Welding Inspector Sample Questions
201019558